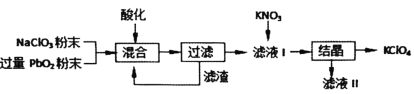
题目内容
【题目】硼镁泥是硼镁矿生产硼砂晶体![]() 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有![]() 、CaO、
、CaO、![]() 、FeO、MnO、
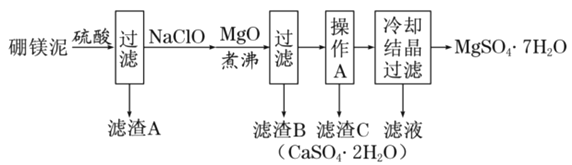
、FeO、MnO、![]() 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
回答下列问题:
(1)![]() 中B的化合价为__________。
中B的化合价为__________。
(2)![]() 易溶于水,也易发生水解:
易溶于水,也易发生水解:![]() 硼酸
硼酸![]() 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小![]() 。写出加入硫酸时
。写出加入硫酸时![]() 发生反应的化学方程式:_____。
发生反应的化学方程式:_____。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知![]() 、
、![]() 的溶解度如下表:
的溶解度如下表:
温度 | 40 | 50 | 60 | 70 |
|
|
|
|
|
|
|
|
|
|
“操作A”是将![]() 和
和![]() 混合溶液中的
混合溶液中的![]() 除去,根据上表数据,简要说明“操作A”步骤为____________________。
除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取![]() ,
,![]() 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。
![]() 写出
写出![]() 的电子式:___________。
的电子式:___________。
![]() “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克![]() 的还原能力。
的还原能力。![]() 的有效氢含量为_________
的有效氢含量为_________![]() 保留两位小数
保留两位小数![]() 。
。
![]() 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解![]() 也可制得硼氢化钠,写出阴极室的电极反应式:________。
也可制得硼氢化钠,写出阴极室的电极反应式:________。
【答案】+3; Na2B4O7+H2SO4+5H2O═Na2SO4+4H3BO3↓ ClO+Mn2++H2O═MnO2+Cl+2H+ 调节溶液的pH值,使![]() 转化为氢氧化铁沉淀除去; 蒸发浓缩、趁热过滤;
转化为氢氧化铁沉淀除去; 蒸发浓缩、趁热过滤;  0.21 BO2+6H2O+8e═BH4+8OH
0.21 BO2+6H2O+8e═BH4+8OH
【解析】
分析流程,硼镁泥中主要有MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质,通过硫酸酸浸,得到滤渣为SiO2,滤液中含有Na+,Ca2+,Fe2+,Fe3+,Mn2+,H+,SO42-,B4O72-,经过NaClO溶液处理,NaClO在酸性溶液中具有一定的氧化性,将Fe2+氧化为Fe3+,将Mn2+氧化为MnO2,加入MgO处理,形成Fe(OH)3和MnO2,这就是滤渣B,滤液经过蒸发浓缩,趁热过滤,得到滤渣C为CaSO42H2O,此时滤液中存在Na+,B4O72-,SO42-,Mg2+,滤液经过冷却结晶,得到MgSO47H2O和硼砂溶液,据此分析;
(1)根据物质呈电中性原理,计算B的化合价;
(2)硼砂水解产生H3BO3,H3BO3是弱酸,在硼砂溶液中加入硫酸,可以制得H3BO3,据此写出反应的化学方程式;
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,根据流程分析,应为MnO2,由NaClO在酸性溶液中氧化Mn2+得到,据此写出反应的离子方程式;
(4)加入MgO,使溶液中Fe3+产生Fe(OH)3沉淀,除去Fe3+,据此分析加入MgO的作用;
(5)操作“A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据溶解性数据的分析操作A的步骤;
(6)①NaBH4的电子式,存在Na+和BH4-,据此写出电子式;
②根据有效含氢量的定义,每克含氢还原剂的还原能力相当于多少克H2的还原能力,H2做还原剂,1molH2失去电子2mol,结合电子得失守恒计算;
③碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,阴极处发生的反应为物质得到电子,发生还原反应,考虑到溶液为碱性,OH-参加反应或反应生成OH-,据此写出电极反应式。
(1)根据物质呈电中性原理,Na2B4O710H2O中Na为+1价,O为2价,则B的化合价为![]() =+3;
=+3;
(2)硼砂水解产生H3BO3,H3BO3是弱酸,在硼砂溶液中加入硫酸,可以制得H3BO3,则加入硫酸时Na2B4O7发生反应的化学方程式为:Na2B4O7+H2SO4+5H2O═Na2SO4+4H3BO3;
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,根据流程分析,应为MnO2,由NaClO在酸性溶液中氧化Mn2+得到,考虑到介质为酸性,H+参与反应或反应生成H+,则生成黑色固体的离子方程式为:ClO+Mn2++H2O═MnO2+Cl+2H+;
(4)加入MgO,使溶液中Fe3+产生Fe(OH)3沉淀,除去Fe3+,则加入MgO的目的是:调节溶液的pH值,使Fe3+转化为Fe(OH)3除去,;
(5)操作“A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据溶解性的数据分析,随着温度的升高,MgSO4的溶解度增加,CaSO4的溶解度降低,可见随着温度升高,二者溶解度差别增大,因此可考虑操作A中对溶液蒸发浓缩,可以析出大量的CaSO4固体,在温度高时,进行趁热过滤可以达到分离的目的;
(6)①NaBH4的电子式,存在Na+和BH4,则NaBH/span>4的电子式为: ;
;
②根据有效含氢量的定义,每克含氢还原剂的还原能力相当于多少克H2的还原能力,H2做还原剂,1molH2失去电子2mol,1gH2的物质的量为![]() =0.5mol,0.5molH2转移的电子数为1mol,根据电子得失守恒,NaBH4也应转移1mol电子,NaBH4中H为1价,做还原剂时,H从1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,则转移1mol电子消耗NaBH4的物质的量为0.125mol,其质量为0.125mol×38g/mol=4.75g,即1gH2相当于4.75gNaBH4,那么1gNaBH4相当于
=0.5mol,0.5molH2转移的电子数为1mol,根据电子得失守恒,NaBH4也应转移1mol电子,NaBH4中H为1价,做还原剂时,H从1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,则转移1mol电子消耗NaBH4的物质的量为0.125mol,其质量为0.125mol×38g/mol=4.75g,即1gH2相当于4.75gNaBH4,那么1gNaBH4相当于![]() gH2,即0.21gH2;
gH2,即0.21gH2;
③碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,阴极处发生的反应为物质得到电子,发生还原反应,考虑到溶液为碱性,OH参加反应或反应生成OH,则阴极室的电极反应式为:BO2+6H2O+8e═BH4+8OH。