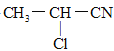题目内容
【题目】工业用强氧化剂PbO2来制备KClO4的工业流程如下:
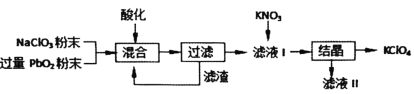
根据流程推测,下列判断不正确的是( )
A.“酸化”的试剂是稀硝酸或浓盐酸
B.“滤渣”主要成分是PbO2粉末,可循环使用
C.NaClO3与PbO2反应的离子方程式为![]()
D.在KNO3、KClO4、NaClO4、NaNO3中,常温下溶解度小的是KClO4
【答案】A
【解析】
工业用PbO2来制备KClO4,是在酸性条件下用PbO2将NaClO3氧化成NaClO4,过滤得含有NaClO4的溶液中加入硝酸钾,经结晶可得KClO晶体,
A.浓盐酸具有还原性会与NaClO3发生归中反应,同时也会消耗PbO2,故A错误;
B. “滤渣”主要成分是PbO2粉末,可循环使用,B正确;
C.根据产物可知NaClO3被PbO2氧化,根据电子守恒和元素守恒可知离子方程式为:![]() ,故C正确;
,故C正确;
D. 根据溶液中溶解度小的物质先析出,结合复分解反应的条件可判断溶解度较小的物质为KClO4,故D正确;
故答案为A。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
X | ||
Y | ||
Z | M |
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子排布图为![]()
【题目】硼镁泥是硼镁矿生产硼砂晶体![]() 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有![]() 、CaO、
、CaO、![]() 、FeO、MnO、
、FeO、MnO、![]() 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
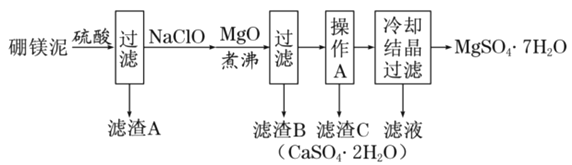
回答下列问题:
(1)![]() 中B的化合价为__________。
中B的化合价为__________。
(2)![]() 易溶于水,也易发生水解:
易溶于水,也易发生水解:![]() 硼酸
硼酸![]() 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小![]() 。写出加入硫酸时
。写出加入硫酸时![]() 发生反应的化学方程式:_____。
发生反应的化学方程式:_____。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知![]() 、
、![]() 的溶解度如下表:
的溶解度如下表:
温度 | 40 | 50 | 60 | 70 |
|
|
|
|
|
|
|
|
|
|
“操作A”是将![]() 和
和![]() 混合溶液中的
混合溶液中的![]() 除去,根据上表数据,简要说明“操作A”步骤为____________________。
除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取![]() ,
,![]() 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。
![]() 写出
写出![]() 的电子式:___________。
的电子式:___________。
![]() “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克![]() 的还原能力。
的还原能力。![]() 的有效氢含量为_________
的有效氢含量为_________![]() 保留两位小数
保留两位小数![]() 。
。
![]() 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解![]() 也可制得硼氢化钠,写出阴极室的电极反应式:________。
也可制得硼氢化钠,写出阴极室的电极反应式:________。