题目内容
在相同温度压强下,实验室制得的下列体积的气体密度由大到小的顺序正确的是( )
①10mL O2 ②20mL H2 ③30mL Cl2 ④40mL CO2.
①10mL O2 ②20mL H2 ③30mL Cl2 ④40mL CO2.
| A、③④①② | B、④③②① |
| C、①②③④ | D、无法确定 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:同温同压下,气体的Vm相同,由ρ=
=
可知,气体的密度与气体的摩尔质量呈正比,以此解答该题.
| m |
| V |
| M |
| Vm |
解答:
解:同温同压下,气体的Vm相同,由ρ=
=
可知,气体的密度与气体的摩尔质量呈正比,
①的摩尔质量为32g/mol,②的摩尔质量为2g/mol,③的摩尔质量为71g/mol,④的摩尔质量为44g/mol,
则气体密度由大到小的顺序为③④①②,
故选:A.
| m |
| V |
| M |
| Vm |
①的摩尔质量为32g/mol,②的摩尔质量为2g/mol,③的摩尔质量为71g/mol,④的摩尔质量为44g/mol,
则气体密度由大到小的顺序为③④①②,
故选:A.
点评:本题考查阿伏伽德罗定律及其推论,侧重于学生的分析能力和计算能力的考查,难度不大,注意相关计算公式的运用和推导,把握密度比较的角度.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
在配制一定物质的量浓度的溶液的实验中,下列操作正确的是( )
| A、将氢氧化钠固体放在天平托盘的滤纸上,精确称量并放入烧杯中溶解后,立即注入容量瓶中 |
| B、将准确量取的18.4mol?L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
| C、仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液 |
| D、欲配制1000mL 0.1mol?L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线 |
将a mol的Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,下列说法错误的是( )
| A、当剩余固体为Na2CO3,排出气体为O2,H2O时,a:b=1:2 | ||
B、当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,
| ||
| C、当a:b>1时,剩余固体为Na2O2,Na2CO3,NaOH,排出气体为O2 | ||
| D、当排出的O2和H2O为等物质的量时,则a:b=3:2 |
 如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )
如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )| A、该反应的化学方程式可表达为2M+N?2P |
| B、在反应时间为20min-25min之内,物质M的反应速率为0.002mol/(L?min) |
| C、当反应时间为20min时,曲线开始发生变化的原理可能是由于增大压强引起的 |
| D、反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的(其它条件不变),则该反应的正反应一定为吸热反应 |
实现下列转化,必须加入氧化剂或还原剂的是( )
| A、Cl2→HClO+HCl |
| B、NH4+→NH3 |
| C、NH3→NO |
| D、P2O5→H3PO4 |
下列叙述正确的是( )
| A、水的摩尔质量是18g |
| B、HCl的摩尔质量等于NA个HCl分子的质量 |
| C、摩尔是七个基本物理量之一 |
| D、1mol CO2的质量以克为单位时,在数值上等于CO2的相对分子质量 |
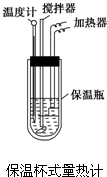 在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.