题目内容
8.下列溶液中,H+的物质的量浓度为1mol/L的是( )| A. | 将1 mol HCl溶于1 L水中得到的溶液 | |
| B. | 将1 mol SO3溶于1 L水中得到的溶液 | |
| C. | 将1 mol H2SO4溶于水制成的体积1 L的溶液 | |
| D. | 将0.5 mol SO3溶于水制成的体积1 L的溶液 |
分析 A.HCl溶液中完全电离,溶液1L水中溶液体积不是1L;
B.三氧化硫和水反应生成硫酸,溶液体积不是1L;
C.1 mol H2SO4溶于水完全电离出2mol氢离子;
D.0.5 mol SO3溶于水生成0.5molH2SO4,氢离子物质的量为1mol.
解答 解:A.HCl溶液中完全电离,溶液1L水中溶液体积不是1L,溶液中氢离子浓度<1mol/L,故A错误;
B.三氧化硫和水反应生成硫酸,1 mol SO3溶于1 L水中反应生成1mol硫酸,含2mol氢离子,溶液体积不是1L,故B错误;
C.1 mol H2SO4溶于水完全电离出2mol氢离子,制成的体积1 L的溶液中氢离子浓度2mol/L,故C错误;
D.0.5 mol SO3溶于水生成0.5molH2SO4,氢离子物质的量为1mol,制成的体积1 L的溶液,H+的物质的量浓度为1mol/L,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意溶液体积的判断,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
3.下列有关实验操作、发生的现象、解释或结论都正确的是( )
| 选项 | 实验操作 | 发生的现象 | 解释或结论 |
| A | 向亚硫酸钠溶液中,逐滴加入硝酸酸化的硝酸钡溶液 | 产生白色沉淀 | 产生的亚硫酸钡是难溶解于水的沉淀 |
| B | 将SO2通入滴有酸性高锰酸钾溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 常温下铜片插入硝酸中 | 产生白色沉淀 | 常温下铜和硝酸一定产生NO2 |
| D | 向某溶液中加入NaHCO3 | 产生白色沉淀 | 该溶液可能原来含有氢氧化钡 |
| A. | A | B. | B | C. | C | D. | D |
19.用 0.50mol•L-1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
| A. | 若选用酚酞作指示剂,终点时,液体恰好褪色 | |
| B. | 用量筒量取上述盐酸 | |
| C. | 若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大 | |
| D. | 盐酸的浓度为1.00 mol•L-1 |
16.下列物质的提纯方法可能属于化学变化的是 )
| A. | 蒸馏 | B. | 渗析 | C. | 过滤 | D. | 洗气 |
13.乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是( )
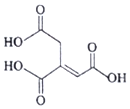

| A. | 化学式为C6H6O6 | |
| B. | 乌头酸含有三种官能团 | |
| C. | 乌头酸能使酸性高锰酸钾溶液褪色 | |
| D. | 含l mol乌头酸的溶液最多可消耗3 mol NaOH |
20.下列物质中,是人体必需的营养成分之一,给人体提供能量的是( )
| A. | 食盐 | B. | 水 | C. | 糖类 | D. | 陈醋 |
17.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同 | |
| B. | 大量排放NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| C. | 大量燃烧化石燃料排放的废气中含有大量SO2,造成大气污染,从而使雨水的pH=5.6,形成酸雨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
18.下列说法中,正确的是( )
| A. | 硅元素在自然界里均以化合态存在 | |
| B. | SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2=Si+CO2↑ |
 烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答:
烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答: