题目内容
将7.1g Na2SO4放人足量水中完全溶解,得200g Na2SO4溶液(密度为1.2g/cm3),则该溶液中含有溶质Na2S04的物质的量为 ,溶液中Na+的物质的量为 ,SO42-的物质的量为 ,此溶液中Na2SO4的物质的量浓度为 .
考点:物质的量的相关计算
专题:
分析:根据n=
计算7.1g Na2SO4的物质的量;1mol硫酸钠电离产生2mol钠离子、1mol硫酸根,故钠离子物质的量为硫酸钠的2倍,硫酸根物质的量等于硫酸钠,根据V=
计算溶液的体积,再根据c=
计算溶液物质的量浓度.
| m |
| M |
| m |
| ρ |
| n |
| V |
解答:
解:7.1g Na2SO4的物质的量为
=0.05mol;1mol硫酸钠电离产生2mol钠离子、1mol硫酸根,故n(Na+)=2n(Na2SO4)=0.05mol×2=0.1mol,n(SO42-)=n(Na2SO4)=0.05mol,溶液的体积为
=
L,故溶液物质的量浓度为
=0.3mol/L,
故答案为:0.05mol;0.1mol;0.05mol;0.3mol/L.
| 7.1g |
| 142g/mol |
| 200g |
| 1200g/L |
| 1 |
| 6 |
| 0.05mol | ||
|
故答案为:0.05mol;0.1mol;0.05mol;0.3mol/L.
点评:本题考查物质的量的有关计算,比较基础,注意对公式的理解,侧重对基础知识的巩固.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
20mLCaCl2溶液加水稀释至100mL,稀释后的溶液中Cl-离子的物质的量浓度为1mol/L,则稀释前CaCl2的物质的量浓度为( )
| A、2.5mol/L |
| B、5mol/L |
| C、1.25 mol/L |
| D、2mol/L |
与纯水的电离相似,液氨中存在着微弱的电离:2NH3═NH4++NH2-,据此判断以下叙述中错误的是( )
| A、液氨中含有NH3、NH4+、NH2- |
| B、一定温度下,液氨中,c(NH4+)?c(NH2-)是一个常数 |
| C、液氨的最离达到平衡时c(NH3)=c(NH4+)=c(NH2-) |
| D、只要不加入其他物质,液氨中一定有c(NH4+)=c(NH2-) |
下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A、KCl晶体、BaC03 |
| B、铁、二氧化硫 |
| C、液态的醋酸、乙醇 |
| D、熔融的K2SO4、盐酸溶液 |
下列说法正确的是( )
| A、71 g氯相当于2 mol氯 |
| B、每摩尔物质中含有6.02×1023个原子 |
| C、阿伏加德罗常数为12 g 12C所含的碳原子数 |
| D、1 mol KClO3中含有3 mol氧元素 |
用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、常温常压下,18gH2O所含原子数为NA |
| B、常温常压下,11.2L氧气含原子数为NA |
| C、2.3g金属钠变为钠离子失去0.1NA电子 |
| D、在同温同压时,相同体积的任何气体单质都含有相同数目的原子 |
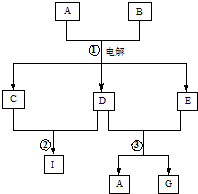 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)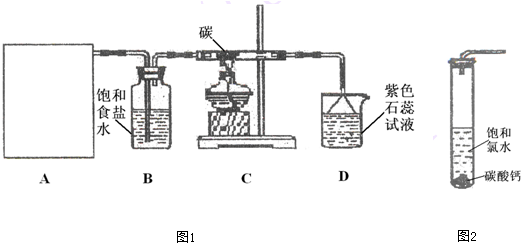
 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.根据所学知识,回答下列问题:
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.根据所学知识,回答下列问题: