题目内容
18.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 使pH试纸变蓝色的溶液中:K+、Al3+、NO3-、SO42- | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的溶液中:NH4+、Cu2+、Cl-、SO42- | |
| C. | 有较多Fe3+的溶液中:Na+、SCN-、K+、Na+、CO32- | |
| D. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、Cl- |
分析 A.使pH试纸变蓝色的溶液是碱性溶液;
B.室温下,$\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的溶液是酸性溶液;
C.Fe3+、SCN-会发生络合反应;Fe3+、CO32-发生双水解反应;
D.与Al反应能放出H2的溶液可能是酸性溶液,也可能是碱性溶液.
解答 解:A.使pH试纸变蓝色的溶液是碱性溶液,在碱性溶液中,OH-、Al3+会发生反应形成Al(OH)3沉淀,不能大量共存,故A错误;
B.室温下,$\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的溶液是酸性溶液,此时:溶液中的离子不能发生任何反应,可以大量共存,故B正确;
C.Fe3+、SCN-会发生络合反应,形成Fe(SCN)3;Fe3+、CO32-发生双水解反应,不能大量共存,故C错误;
D.与Al反应能放出H2的溶液可能是酸性溶液,也可能是碱性溶液.在酸性溶液中,H+、Fe2+、NO3-会发生氧化还原反应,不能大量共存;在碱性溶液中,OH-、Fe3+会发生反应形成Fe(OH)3沉淀,不能大量共存,故D错误.
点评 本题考查了离子共存,为高考常见题型,题目难度中等,明确离子反应发生条件为解答关键,注意掌握题干暗含条件的含义,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
8.核磁共振仪测定某有机物的结构,到如图所示的核磁共振氢谱,则该有机物可能是( )

| A. | C2H5OH | B. |  | C. |  | D. |  |
6.某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到目的是( )
| A. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 电解CuCl2溶液,若阳极生成11.2L的气体,反应中转移电子为1 mol | |
| D. | 将表面有铜绿的铜器放入盐酸中浸泡,除去铜绿 |
13.有一种兴奋剂的结构简式为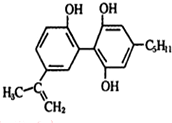 ,有关该物质的说法正确的是( )
,有关该物质的说法正确的是( )
 ,有关该物质的说法正确的是( )
,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4酸性溶液,观察到紫色褪去,可证明分子中存在双键 | |
| C. | 1mol该物质与足量的碳酸氢钠反应,产生3molCO2 | |
| D. | 1 mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol |
10.下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液洗涤石油产品中的残余硫酸
②用碳酸氢钠治疗胃酸过多
③用熟石灰改良酸性土壤
④用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒.
①用氢氧化钠溶液洗涤石油产品中的残余硫酸
②用碳酸氢钠治疗胃酸过多
③用熟石灰改良酸性土壤
④用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒.
| A. | ①② | B. | ②③④ | C. | ②③ | D. | ①③④ |
7.设NA为阿伏加德罗常数值.下列有关说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 5.6LCO2气体中含有的氧原子数为0.5NA |
5.要用VL水制得物质的量浓度为a mol/L的氨水(密度为d g/com3),需标准状况下氨气的体积为( )
| A. | 22.4aVL | B. | $\frac{22.4aV}{(1-22.4a)}$ | ||
| C. | $\frac{22400aV}{(1000d-17a)L}$ | D. | $\frac{22400aV}{(1000d+17a)L}$ |

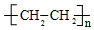 ;
;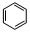 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$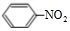 +H2O.
+H2O. ;
; .
.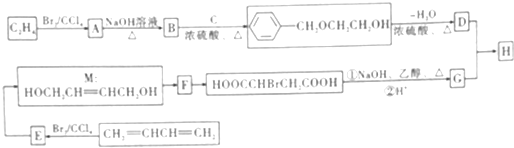
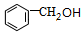 ,F中官能团的名称为羟基、溴原子
,F中官能团的名称为羟基、溴原子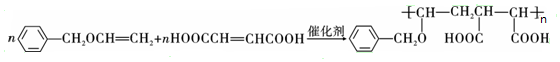
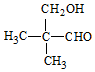 或
或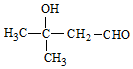 .
.