题目内容
工业上采用如图甲工艺流程将石油废气中的硫化氢转化为硫酸和氢气等产品以防止污染.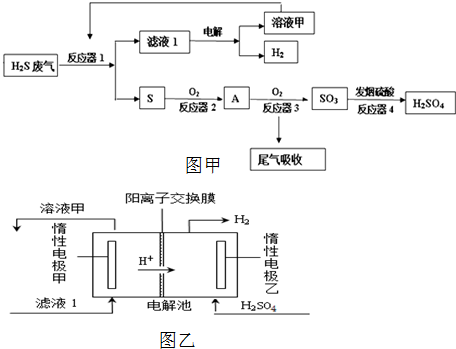
(1)反应器1中装有硫酸铁的酸性溶液.
①配制硫酸铁溶液时,需加入适量的硫酸,请用化学平衡移动原理解释原因 .
②反应器1中发生反应的离子方程式是 .
(2)反应器3中发生反应的化学方程式是 .
(3)工业上用氨水和热空气吸收处理尾气中的二氧化硫以生产氮肥,该反应的化学方程式是 .
(4)电解滤液1的工作原理示意图如图乙:
①乙电极是 (填“阴”或“阳”)极.
②甲电极的电极反应式是 .
③电解滤液1的离子方程式是 .

(1)反应器1中装有硫酸铁的酸性溶液.
①配制硫酸铁溶液时,需加入适量的硫酸,请用化学平衡移动原理解释原因
②反应器1中发生反应的离子方程式是
(2)反应器3中发生反应的化学方程式是
(3)工业上用氨水和热空气吸收处理尾气中的二氧化硫以生产氮肥,该反应的化学方程式是
(4)电解滤液1的工作原理示意图如图乙:
①乙电极是
②甲电极的电极反应式是
③电解滤液1的离子方程式是
考点:"三废"处理与环境保护,原电池和电解池的工作原理
专题:实验设计题,元素及其化合物
分析:(1)①铁离子水解生成氢氧化铁变浑浊,配制硫酸铁溶液时,加入适量的硫酸,硫酸抑制铁离子的水解;
②根据Fe3+的氧化性与与H2S的还原性判断二者之间的反应,以此书写反应的离子方程式;
(2)反应器3中发生二氧化硫的催化氧化,该反应为可逆反应;
(3)氨水呈碱性,可与酸性氧化物反应,二氧化硫具有还原性可被氧气氧化;
(4)反应①是三价铁和硫离子反应,产物滤液为亚铁离子,电解阳极发生氧化反应,阴极发生还原反应,根据图示电极乙生成氢气,所以甲电极为阳极亚铁离子失电子,乙电极为阴极,据此分析解答.
②根据Fe3+的氧化性与与H2S的还原性判断二者之间的反应,以此书写反应的离子方程式;
(2)反应器3中发生二氧化硫的催化氧化,该反应为可逆反应;
(3)氨水呈碱性,可与酸性氧化物反应,二氧化硫具有还原性可被氧气氧化;
(4)反应①是三价铁和硫离子反应,产物滤液为亚铁离子,电解阳极发生氧化反应,阴极发生还原反应,根据图示电极乙生成氢气,所以甲电极为阳极亚铁离子失电子,乙电极为阴极,据此分析解答.
解答:
解:(1)①因为铁离子会水解,生成氢氧化铁,Fe3++3H2O?Fe(OH)3+3H+;加入硫酸的目的是在溶液里面形成一种酸性条件,抑制氢氧化铁的生成,使得所配的溶液不会有沉淀,得到较纯净的硫酸铁溶液,
故答案为:Fe3++3H2O?Fe(OH)3+3H+,加入硫酸,增加c(H+),使平衡逆向移动,抑制Fe3+水解;
②在酸性溶液中,具有氧化性的Fe3+与具有还原性的H2S发生氧化还原反应,反应的离子方程式为2Fe3++H2S=2Fe2++2H++S↓,
故答案为:2Fe3++H2S=2Fe2++2H++S↓;
(2)硫和氧气反应生成二氧化硫,所以A为二氧化硫,反应器3中生成物为三氧化硫,所以反应器3中发生二氧化硫的催化氧化,反应为:2SO2+O2 2SO3,
2SO3,
故答案为:2SO2+O2 2SO3;
2SO3;
(3)二氧化硫具有还原性,可被氧气氧化,氨水呈碱性,可与具有酸性的SO3发生反应,用氨水和热空气吸收处理尾气中的二氧化硫,生成硫酸铵和水,反应为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O,
故答案为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O;
(4)①反应①产物滤液为亚铁离子,电解,亚铁离子失去电子,水中的氢得电子,根据图示电极乙生成氢气,所以乙电极为阴极氢离子得电子,
故答案为:阴;
②电解阳极发生氧化反应,阴极发生还原反应,根据图示电极乙生成氢气,所以甲电极为阳极亚铁离子失电子,反应为:Fe2+-e-═Fe3+,
故答案为:Fe2+-e-═Fe3+;
③反应①产物滤液为亚铁离子,电解,亚铁离子失去电子,水中的氢得电子,总反应为:2Fe2++2H+
2Fe3++H2↑,
故答案为:2Fe2++2H+
2Fe3++H2↑.
故答案为:Fe3++3H2O?Fe(OH)3+3H+,加入硫酸,增加c(H+),使平衡逆向移动,抑制Fe3+水解;
②在酸性溶液中,具有氧化性的Fe3+与具有还原性的H2S发生氧化还原反应,反应的离子方程式为2Fe3++H2S=2Fe2++2H++S↓,
故答案为:2Fe3++H2S=2Fe2++2H++S↓;
(2)硫和氧气反应生成二氧化硫,所以A为二氧化硫,反应器3中生成物为三氧化硫,所以反应器3中发生二氧化硫的催化氧化,反应为:2SO2+O2
 2SO3,
2SO3,故答案为:2SO2+O2
 2SO3;
2SO3;(3)二氧化硫具有还原性,可被氧气氧化,氨水呈碱性,可与具有酸性的SO3发生反应,用氨水和热空气吸收处理尾气中的二氧化硫,生成硫酸铵和水,反应为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O,
故答案为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O;
(4)①反应①产物滤液为亚铁离子,电解,亚铁离子失去电子,水中的氢得电子,根据图示电极乙生成氢气,所以乙电极为阴极氢离子得电子,
故答案为:阴;
②电解阳极发生氧化反应,阴极发生还原反应,根据图示电极乙生成氢气,所以甲电极为阳极亚铁离子失电子,反应为:Fe2+-e-═Fe3+,
故答案为:Fe2+-e-═Fe3+;
③反应①产物滤液为亚铁离子,电解,亚铁离子失去电子,水中的氢得电子,总反应为:2Fe2++2H+
| ||
故答案为:2Fe2++2H+
| ||
点评:本题考查含硫化合物的性质综合应用,侧重考查方程式书写、电解原理的应用,注意掌握二氧化硫的还原性和酸性,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol有机物 一定条件下能和7molNaOH反应. 一定条件下能和7molNaOH反应. |
下列说法不正确的是( )
A、 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 |
| B、金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 |
| C、探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 |
| D、可用热氢氧化钠溶液鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等) |
下列有关实验正确的是( )
A、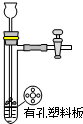 装置用于Na2SO3和浓H2SO4反应制取少量的SO2气体 |
B、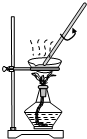 装置用于灼烧CuSO4?5H2O |
C、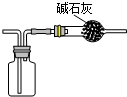 装置用于收集氯气并防止污染空气 |
D、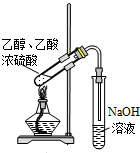 装置用于实验室制备少量乙酸乙酯 |
下列说法正确的是( )
| A、可用饱和溴水除去苯中的苯酚 |
| B、丙烯加聚时可形成顺反两种聚合物 |
| C、常压下的沸点:1-丙醇>乙醇>丙烷 |
| D、蔗糖及其水解产物均能发生银镜反应 |
下列说法错误的是( )
| A、氧化钙用作儿童食品的干燥剂存在安全隐患 |
| B、聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
| C、雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |
| D、绿色化学的核心是利用化学原理对环境污染进行治理 |
 cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是
cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是 
 在一定条件下可水解为
在一定条件下可水解为 和R2-NH2,则F在强酸和长时间加热条件下发生水解反应,水解产物的结构简式为
和R2-NH2,则F在强酸和长时间加热条件下发生水解反应,水解产物的结构简式为