题目内容
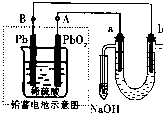
用铅蓄电池(总反应:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是( )
2PbSO4+2H2O电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是( )
A.铅蓄电池放电时的正极反应是:PbO2+4H++2SO42-=PbSO4+2H2O
B.电解苦卤水时,a电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-
C.铅蓄电池充电时,A极应与外接电源负极相连
D.忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 mol H2SO4
【答案】分析:铅蓄电池放电时,铅作负极,二氧化铅作正极,正极上得电子发生还原反应,当铅蓄电池充电时,二氧化铅要连接电源正极;电解苦卤水时,阳极上还原性强的离子先失电子发生氧化反应,根据转移电子相等进行有关计算.
解答:解:A.铅蓄电池放电时,正极发生的反应是PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,故A错误;
B.电解苦卤水时,阳极上还原性强的离子先失电子发生氧化反应,a电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-,故B正确;
C.铅蓄电池充电时,A极应与外接电源正极相连,故C错误;
D.忽略能量消耗,b电极上析出氢气,当b极产生0.02g气体时,转移电子的物质的量= ,根据Pb+PbO2+4H++2SO42-
,根据Pb+PbO2+4H++2SO42- 2PbSO4+2H2O知,铅蓄电池中消耗0.02mol H2SO4,故D错误;
2PbSO4+2H2O知,铅蓄电池中消耗0.02mol H2SO4,故D错误;
故选B.
点评:本题考查原电池和电解池原理,根据原电池正负极和电解池阴阳极上得失电子分析解答,难度不大.
解答:解:A.铅蓄电池放电时,正极发生的反应是PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,故A错误;
B.电解苦卤水时,阳极上还原性强的离子先失电子发生氧化反应,a电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-,故B正确;
C.铅蓄电池充电时,A极应与外接电源正极相连,故C错误;
D.忽略能量消耗,b电极上析出氢气,当b极产生0.02g气体时,转移电子的物质的量=
 ,根据Pb+PbO2+4H++2SO42-
,根据Pb+PbO2+4H++2SO42- 2PbSO4+2H2O知,铅蓄电池中消耗0.02mol H2SO4,故D错误;
2PbSO4+2H2O知,铅蓄电池中消耗0.02mol H2SO4,故D错误;故选B.
点评:本题考查原电池和电解池原理,根据原电池正负极和电解池阴阳极上得失电子分析解答,难度不大.

练习册系列答案
相关题目
 (2010?崇文区二模)用铅蓄电池(总反应:Pb+PbO2+4H++2SO42-
(2010?崇文区二模)用铅蓄电池(总反应:Pb+PbO2+4H++2SO42-
 2PbSO;+2H2O电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是 ( )
2PbSO;+2H2O电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是 ( )
 2PbSO4+2H2O)电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示
(a、b为石墨电极)。
2PbSO4+2H2O)电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示
(a、b为石墨电极)。

 2PbSO4;+2H2O电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。
2PbSO4;+2H2O电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。