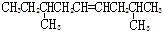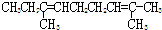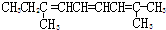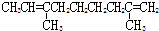题目内容
19.某铁质容器材料为碳素钢,可盛装冷浓硫酸.为研究该材料与热浓硫酸的反应,某学习小组进行了以下实验:取5.60g该材料放入15.0mL浓硫酸中加热,充分反应后得到溶液X并收集到气体Y.
(1)为分析溶液中的成分,甲组通过实确定X中一定含Fe3+,但还可能有Fe2+,为确定是否含有Fe2+,可另取溶液加入BD(填序号)
A.KSCN溶液和氯水 B.K3[Fe(CN)6]溶液 C.NaOH溶液 D.酸性KMnO4 溶液
(2)为分析气体中的成分,乙组将560mL (标准状况)气体Y通入足量溴水,然后向该溶液中加入足量BaCl2 溶液,经适当操作后得干燥固体2.33g.由此推知气体Y中SO2的体积分数为40.0%
(3)提出猜想:乙组根据上述SO2体积分数,分析Y中还可能有其它气体,并作如下猜想:
猜想一:其它气体中只有H2;猜想二:Y气体中可能含有CO2;猜想三:Y气体中可能含有H2和CO2
(4)验证猜想:设计用下图装置进行探究 (部分装置可重复使用,夹持仪器省略)

①实验装置连接顺序为ABCFEDF
②装置B中试剂作用为检验SO2是否除尽
③若猜想一成立,预测实验现象为(石灰水不浑浊)D中固体由白色变蓝色、E中固体由黑色变红色.
分析 (1)实验:①亚铁离子具有还原性,高锰酸钾溶液呈紫色,具有氧化性,可与亚铁离子在酸性条件下反应,据此可以具有亚铁离子;
(2)依据二氧化硫被溴单质氧化生成硫酸,硫元素守恒,加入氯化钡溶液产生沉淀硫酸钡,计算沉淀物质的量得到硫元素物质的量,计算得到二氧化硫的体积分数;
【提出猜想】:(3)用于浓硫酸能够与碳单质反应,所以混合气体中可能含有二氧化碳;浓硫酸变成稀硫酸,稀硫酸与铁反应生成氢气,据此完成假设;
(4)①验证气体存在的顺序为:SO2→CO2→CO和H2被氧化→H2O→CO2,实验中要避免其它物质的性质干扰;
②检验CO2气体的存在应先除去SO2气体并检验是否除尽;
③含有H2,与CuO在加热条件下反应生成铜和水,以此来判断反应现象.
解答 解:(1)实验:①亚铁离子能使酸化的高锰酸钾褪色,溶液中已经有Fe3+,选择A会造成干扰,选项B能检验溶液中含有+2价铁离子,C选项会造成两种沉淀,受氢氧化铁颜色的影响无法辨别,D选项酸性KMnO4 溶液遇到亚铁离子发生氧化还原反应高锰酸钾溶液褪色,可以检验亚铁离子存在的试剂,
只能选BD,
故答案为:BD;
(2)依据二氧化硫被溴单质氧化生成硫酸,硫元素守恒,SO2+2H2O=H2SO4+2HBr,H2SO4+BaCl2=BaSO4↓+2HCl,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol
SO2~BaSO4
1 1
0.01mol 0.01mol
计算得到二氧化硫的体积分数=$\frac{0.01mol×22.4L/mol}{0.56L}$×100%=40.0%,
故答案为:40.0%;
【提出猜想】(3)碳素钢中含有碳元素,碳能够与浓硫酸在加热条件下反应生成二氧化碳,所以混合气体中可能含有二氧化碳气体;铁和浓硫酸反应生成二氧化硫,随反应进行硫酸浓度减小变为稀硫酸后铁和稀硫酸反应生成氢气,所以可能情况有如下三种:猜想一:Y气体中可能含有H2;猜想二:Y气体中可能含有CO2;猜想三:Y气体中可能含有H2和CO2 ,
故答案为:Y气体中可能含有CO2;Y气体中可能含有H2和CO2 ;
(4)①碳素钢中含有碳元素,推断所的气体中可能含有二氧化碳,结合图中设计装置的目的,可知检验二氧化碳的方法是首先将二氧化硫除去→确认二氧化硫已经完全除去→澄清石灰水,对于氢气的检验则可通过与灼热氧化铜的反应现象和对产物水的验证来实现,验证气体存在的顺序为:SO2→CO2→CO和H2被氧化→H2O→CO2,实验中要避免其它物质的性质干扰,最防止空气成分的干扰,后需要即为A→B→C→F→E→D→F,
故答案为:ABCFEDF;
②CO2气体和SO2气体都能使澄清石灰水变浑浊,检验CO2气体的存在应先除去SO2气体并检验是否除尽,
故答案为:检验SO2是否除尽;
③含有H2,与CuO在加热条件下反应生成铜和水,E中固体由黑色氧化铜生成红色铜,D中无色硫酸铜吸水生成五水硫酸铜蓝色晶体,
故答案为:(石灰水不浑浊)D中固体由白色变蓝色、E中固体由黑色变红色.
点评 本题考查浓硫酸的性质、常见气体的检验,题目较为综合,具有一定难度,做题时注意把握物质的性质是解答本题的关键,特别是要排除其它物质的干扰.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | 加压有利于化学平衡向正反应方向移动 | |
| B. | 该反应的化学平衡常数表达式为:K=$\frac{{c}^{2}{N}_{2}{H}_{4}×{c}^{2}N{O}_{2}}{{c}^{3}{N}_{2}×{c}^{4}{H}_{2}O}$ | |
| C. | 升高温度可缩短反应达平衡的时间但不能提高平衡转化率 | |
| D. | 使用催化剂可缩短反应达平衡的时间但不能提高平衡转化率 |
| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子4 mol | |
| C. | O2一定是氧化产物 | |
| D. | Na2O2不可能发生还原反应 |
| A. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 | |
| B. | 60g SiO2中含硅氧键数目为4NA | |
| C. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 3.9gNa2O2中所含的阴离子数目为0.1NA |

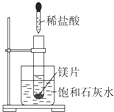 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题: 如图是初中化学中常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体;乙和丁为黑色固体.
如图是初中化学中常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体;乙和丁为黑色固体.