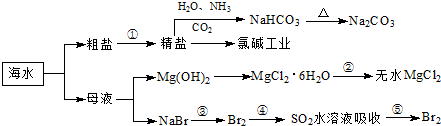
题目内容
下列有关碳酸钠或碳酸氢钠能发生水解的观点正确的是( )
| A、在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,通入CO2,平衡朝正反应方向移动 | B、25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,只存在电离平衡,不存在水解平衡 | C、热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力降低 | D、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
分析:A.二氧化碳为酸性气体,能和碱性溶液反应,通入二氧化碳和氢氧根离子反应促进水解;
B.在水溶液中碳酸氢根存在电离平衡和水解平衡;
C.根据纯碱去油污的原理判断;
D.三种溶液都呈碱性,设三种溶液的pH均为a,c(OH-)=10-amol/L,c(NaOH)=10-amol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-amol/L;
B.在水溶液中碳酸氢根存在电离平衡和水解平衡;
C.根据纯碱去油污的原理判断;
D.三种溶液都呈碱性,设三种溶液的pH均为a,c(OH-)=10-amol/L,c(NaOH)=10-amol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-amol/L;
解答:解:A.Na2CO3溶液存在水解平衡,溶液呈碱性,向Na2CO3溶液中通入CO2,二氧化碳和水反应生成的H2CO3可以与OH-反应,平衡朝正反应方向移动,故A正确;
B.NaHCO3在水溶液中存在碳酸氢根离子的电离平衡和水解平衡以及水的电离平衡,故B错误;
C.纯碱去油污的原理是油脂在碱性条件下能水解,从而达到去污目的.水解反应是吸热反应,纯碱是碳酸钠属于强碱弱酸盐,升温促进水解,溶液碱性增强,所以去污力增强,故C错误;
D.设三种溶液的pH均为a,c(OH-)=10-amol/L,c(NaOH)=10-amol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-amol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是c(CH3COONa)>c(Na2CO3)>c(NaOH),故D错误;
故选A.
B.NaHCO3在水溶液中存在碳酸氢根离子的电离平衡和水解平衡以及水的电离平衡,故B错误;
C.纯碱去油污的原理是油脂在碱性条件下能水解,从而达到去污目的.水解反应是吸热反应,纯碱是碳酸钠属于强碱弱酸盐,升温促进水解,溶液碱性增强,所以去污力增强,故C错误;
D.设三种溶液的pH均为a,c(OH-)=10-amol/L,c(NaOH)=10-amol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-amol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是c(CH3COONa)>c(Na2CO3)>c(NaOH),故D错误;
故选A.
点评:本题考查Na2CO3和NaHCO3的水解性质,注意把握Na2CO3和NaHCO3性质,以及溶液中碳酸氢根离子存在电离平衡和水解平衡,题目难度不大.

练习册系列答案
相关题目
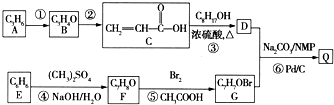







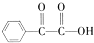


 )氧化生成,写出该反应的化学方程式:
)氧化生成,写出该反应的化学方程式:
 )经浓硫酸催化而生成,写出该反应的化学方程式:
)经浓硫酸催化而生成,写出该反应的化学方程式: