题目内容
下列说法中,不正确的是( )
分析:A.碱性,可以是盐溶液水解呈碱性,只要是由强碱和弱酸组成的盐溶液就能;也可以是碱溶液中碱的电离呈碱性.
B.氢溴酸是强电解质,完全电离,加水相当于稀释,c(H+)减小.
C.常温下,在由水电离出的c(OH-)=1×10-12 mol?L-1的溶液中,溶液可能为强酸性,也可能为强碱性,溶液为强酸性时,Al3+可以大量存在.
D.明矾化学式为:KAl(SO4)2?12H2O,明矾溶于水后,除水外,全部电离出离子,Al3+水解生成氢氧化铝胶体,胶体有吸附性,吸附水中的杂质,从而达到净水的目的.
B.氢溴酸是强电解质,完全电离,加水相当于稀释,c(H+)减小.
C.常温下,在由水电离出的c(OH-)=1×10-12 mol?L-1的溶液中,溶液可能为强酸性,也可能为强碱性,溶液为强酸性时,Al3+可以大量存在.
D.明矾化学式为:KAl(SO4)2?12H2O,明矾溶于水后,除水外,全部电离出离子,Al3+水解生成氢氧化铝胶体,胶体有吸附性,吸附水中的杂质,从而达到净水的目的.
解答:解:A.室温下,pH=8的碱性溶液,如乙酸钠溶液呈碱性,pH=8的乙酸钠溶液,CH3COONa═CH3COO-+Na+,而CH3COO-水解,CH3COO-+H2O?CH3COOH+OH-,醋酸电离、水电离都是可逆反应,所以醋酸分子不会消失,它里面就有醋酸分子,所以,室温下,CH3COOH分子可以存在于pH=8的碱性溶液中.故A正确.
B.氢溴酸是强电解质,完全电离,0.1 mol?L-1的氢溴酸,c(H+)=0.1 mol?L-1,加水稀释,n(H+)不变,溶液体积增大,根据计算公式,c(H+)=
,c(H+)减小.故B正确.
C.由水电离出的c(OH-)=1×10-12 mol?L-1的溶液中,若c(H+)=10-12 mol/L;
则 c(OH-)=10-2 mol/L,溶液显碱性.如c(OH-)=10-2 mol/L的氢氧化钠溶液.
若c(OH)=10-12mol/L,则 c(H+)=10-2 mol/L,溶液显酸性.
如c(H+)=10-2 mol/L的盐酸溶液.此时,Al3+可以大量存在.故C错误.
D.明矾化学式为:KAl(SO4)2?12H2O明矾溶于水后,除水外全部电离出离子,
KAl(SO4)2?12H2O=K++Al 3++2SO42-+12 H2O,Al3+水解生成氢氧化铝胶体,Al3++3H2O=Al(OH)3+3H+,氢氧化铝胶体具有吸附性,吸附水中的杂质,从而达到净水的目的.故D正确.
故选C.
B.氢溴酸是强电解质,完全电离,0.1 mol?L-1的氢溴酸,c(H+)=0.1 mol?L-1,加水稀释,n(H+)不变,溶液体积增大,根据计算公式,c(H+)=
| n(H+) |
| V(aq) |
C.由水电离出的c(OH-)=1×10-12 mol?L-1的溶液中,若c(H+)=10-12 mol/L;
则 c(OH-)=10-2 mol/L,溶液显碱性.如c(OH-)=10-2 mol/L的氢氧化钠溶液.
若c(OH)=10-12mol/L,则 c(H+)=10-2 mol/L,溶液显酸性.
如c(H+)=10-2 mol/L的盐酸溶液.此时,Al3+可以大量存在.故C错误.
D.明矾化学式为:KAl(SO4)2?12H2O明矾溶于水后,除水外全部电离出离子,
KAl(SO4)2?12H2O=K++Al 3++2SO42-+12 H2O,Al3+水解生成氢氧化铝胶体,Al3++3H2O=Al(OH)3+3H+,氢氧化铝胶体具有吸附性,吸附水中的杂质,从而达到净水的目的.故D正确.
故选C.
点评:本题是一道考查化学反应原理中有关电解质溶液中离子浓度的综合题.解题需紧紧抓住溶液呈酸碱性的真正原因.

练习册系列答案
相关题目
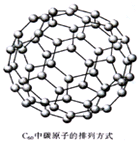 C60的发现导致了一门新兴学科--碳球化学的兴起.根据对其分子结构特点的研究,科学家预测,C60的很多化合物可能在超导体、长效药物载体等方面有着重要的应用.目前已证明,C60与金属钾作用得到一种物质K3C60,其在低温下具有超导性能.下列说法中,不正确的是( )
C60的发现导致了一门新兴学科--碳球化学的兴起.根据对其分子结构特点的研究,科学家预测,C60的很多化合物可能在超导体、长效药物载体等方面有着重要的应用.目前已证明,C60与金属钾作用得到一种物质K3C60,其在低温下具有超导性能.下列说法中,不正确的是( )| A、C60是一种含碳化合物 | B、在C60和 K3C60中,碳元素分别以游离态和化合态存在 | C、K3C60是一种新型的化合物 | D、C60是碳元素的一种单质 |
 如图是某同学设计的储气装置(固定装置已略去),下列说法中,不正确的是( )
如图是某同学设计的储气装置(固定装置已略去),下列说法中,不正确的是( )