题目内容
根据下列各题所给出的数据,得出的结论错误的是( )
A、同温同压下,VLCO和H2的混合气体,完全燃烧消耗O2的体积为
| ||
| B、已知某氢氧化钠溶液中Na+与H2O的个数之比为1:10,则可求出此溶液中氢氧化钠的质量分数约是18% | ||
| C、4.2g氮气和4.8g某单质RX所含原子个数相同,且分子个数之比为1:1,则R的相对原子质量为16 | ||
| D、在10%的NaOH溶液中,平均每9个水分子溶有1个OHˉ |
考点:化学方程式的有关计算
专题:计算题
分析:A.由化学反应方程式:2CO+O2
2CO2、2H2+O2
2H2O,可知消耗氧气体积等于混合气体体积的
;
B.某氢氧化钠溶液中Na+与H2O的个数之比为1:10,则NaOH与H2O的物质的量之比为1:10,根据m=nM及质量分数=
×100%计算;
C.根据n=
计算氮气的物质的量,根据4.8g某单质RX与4.2g氮气所含原子个数相同,且分子个数之比为1:1,进而确定RX的物质的量及x的值,结合M=
确定R的相对原子质量;
D.10%的NaOH溶液为90g水中溶解10g氢氧化钠,再根据n=
计算判断.
| ||
| ||
| 1 |
| 2 |
B.某氢氧化钠溶液中Na+与H2O的个数之比为1:10,则NaOH与H2O的物质的量之比为1:10,根据m=nM及质量分数=
| 溶质质量 |
| 溶液质量 |
C.根据n=
| m |
| M |
| m |
| n |
D.10%的NaOH溶液为90g水中溶解10g氢氧化钠,再根据n=
| m |
| M |
解答:
解:A.由化学反应方程式:2CO+O2
2CO2、2H2+O2
2H2O可知,同温同压下,VLCO和H2的混合气体,完全燃烧消耗O2的体积为
L,故A正确;
B.某氢氧化钠溶液中Na+与H2O的个数之比为1:10,则NaOH与H2O的物质的量之比为1:10,溶液质量分数=
×100%≈18%,故B正确;
C.4.2g氮气的物质的量=
=0.15mol,4.8g某单质RX与4.2g氮气所含原子个数相同,且分子个数之比为1:1,则RX的物质的量为0.15mol,且x=2,R原子物质的量为0.03mol,故R的相对原子质量=
=16,故C正确;
D.10%的NaOH溶液为90g水中溶解10g氢氧化钠,90g水的物质的量=
=5mol,10gNaOH的物质的量=
=0.25mol,水分子与氢氧化钠的物质的量=5mol:0.25mol=20:1,故平均每20个水分子溶有1个OH-,故D错误,
故选D.
| ||
| ||
| V |
| 2 |
B.某氢氧化钠溶液中Na+与H2O的个数之比为1:10,则NaOH与H2O的物质的量之比为1:10,溶液质量分数=
| 1mol×40g/mol |
| 1mol×40g/mol+10mol×18g/mol |
C.4.2g氮气的物质的量=
| 4.2g |
| 28g/mol |
| 4.8 |
| 0.3 |
D.10%的NaOH溶液为90g水中溶解10g氢氧化钠,90g水的物质的量=
| 90g |
| 18g/mol |
| 10g |
| 40g/mol |
故选D.
点评:本题考查化学方程式计算、溶液浓度有关计算、常用化学计量有关计算等,难度中等,注意对基础知识的理解掌握.

练习册系列答案
相关题目
在物质分类中,前者包括后者的是( )
| A、氧化物、化合物 |
| B、化合物、酸性氧化物 |
| C、溶液、胶体 |
| D、溶液、分散系 |
 中国人民银行于2011年10月31日发行2012中国壬辰(龙)年金银纪念币一套.该套纪念币共15枚,其中有七枚纪念币外观为银白色,某同学认为其可能是用铁制成的,于是用磁铁来吸引一下,从化学研究方法的角度来看,“用磁铁吸”是研究物质性质的方法中的( )
中国人民银行于2011年10月31日发行2012中国壬辰(龙)年金银纪念币一套.该套纪念币共15枚,其中有七枚纪念币外观为银白色,某同学认为其可能是用铁制成的,于是用磁铁来吸引一下,从化学研究方法的角度来看,“用磁铁吸”是研究物质性质的方法中的( )| A、实验法 | B、观察法 |
| C、假设法 | D、比较法 |
将3.6g铁铜混合粉末,投入100mL c mol/L的稀硝酸中,金属粉末与硝酸恰好完全反应(还原产物只有NO),向反应后的溶液中加入足量的NaOH溶液,充分反应后将沉淀过滤、洗涤、灼烧至恒重后称量为4.8g.则c值不可能为( )
| A、1.2 | B、1.75 |
| C、2.0 | D、2.4 |
下列物质熔沸点高低比较正确的是( )
| A、SiO2<CO2 |
| B、CCl4<CF4 |
| C、NaCl<HCl |
| D、HF>HCl |
下列反应的离子方程式正确的是( )
| A、碳酸镁溶于硫酸溶液 MgCO3+2H+═Mg2++H2O+CO2↑ |
| B、澄清的石灰水跟稀硝酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| C、氧化钠与稀H2SO4混合 O2-+2H+=H2O |
| D、碳酸钙溶于醋酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
 八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方“达菲”的原材料.莽草酸的结构简式为:下列关于莽草酸的说法正确的是( )
八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方“达菲”的原材料.莽草酸的结构简式为:下列关于莽草酸的说法正确的是( )| A、该化合物的分子式为C7H11O5 |
| B、该化合物的分子处于同一平面的原子只有4个 |
| C、该化合物可以与溴水、NaOH、NaHCO3发生反应 |
| D、该化合物在浓硫酸作用下加热不能制备得到 |
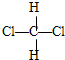 和
和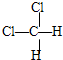 ⑦
⑦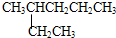 和
和