题目内容
16.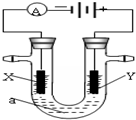 电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:(1)在X极附近观察到的实验现象是:放出气体且溶液变红.检验Y电极反应产物的方法是:把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色.
(2)当通过电解池通过1mol电子时,两极共收集到22.4L气体(标准状况),电解池内的液体稀释到500mL时,NaOH溶液浓度为2mol/L.
分析 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,Y电极上氯离子放电生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验,X电极上氢离子放电,同时该电极附近生成氢氧根离子;
(2)电极总反应式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,转移2mol的电子,生成2mol的气体,同时产生氢氧化钠的物质的量为:2mol,所以当通过电解池通过1mol电子时,两极共收集到1mol气体,标准状况下的体积为:22.4 L,生成1mol的氢氧化钠,根据c=$\frac{n}{V}$.
解答 解:(1)X电极上氢离子放电,同时该电极附近生成氢氧根离子,所以在X极附近观察到的实验现象是有气体产生且溶液变红,检验Y电极反应产物的方法是:湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色,故答案为:溶液变红;湿润的碘化钾淀粉试纸;
(2)电极总反应式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,转移2mol的电子,生成2mol的气体,同时产生氢氧化钠的物质的量为:2mol,所以当通过电解池通过1mol电子时,两极共收集到1mol气体,标准状况下的体积为:22.4 L,生成1mol的氢氧化钠,氢氧化钠的浓度为:c=$\frac{n}{V}$=$\frac{1mol}{0.5L}$=2mol/L,故答案为:22.4;2.
点评 本题考查原电池原理,涉及电极反应式的书写、氯气的检验等知识点,知道离子放电顺序及电极反应式的书写方法、氯气的检验方法及现象,题目难度不大.

练习册系列答案
相关题目
16.目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是( )
①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸
④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体.
①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸
④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体.
| A. | 只有①②④⑤ | B. | 全部 | C. | 只有①② | D. | 只有①②③④ |
17.电视剧《西游记》中仙境美轮美奂,这些神话仙境中所需的烟幕是用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟,又知发生反应后有N2和水生成.有关的说法中正确的是( )
| A. | 水起着溶解NH4NO3,发生吸热现象以启动反应的作用 | |
| B. | 每还原1molNO3需氧化1molZn和1molNH4+ | |
| C. | 成烟物质是两性氧化物小颗粒 | |
| D. | 发烟物质是小锌粒,它由NH4NO3反应放热而蒸出 |
11.下列关于同系物的说法正确的是( )
| A. | 同系物的结构相似,所以物理性相似 | |
| B. | 分子组成差1个或若干个CH2原子团的物质互称为同系物 | |
| C. | 结构相似,分子通式相同,含碳数不同的烃互称为同系物 | |
| D. | 分子通式相同,分子量不同的有机物互称为同系物 |
1.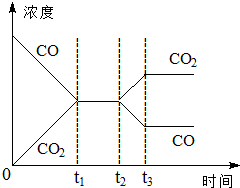 在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:
在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:
(1)该反应的正反应为放热反应.(填“吸热”或“放热”)
(2)830℃时,向反应器中投入1mol CO(g)、2mol H2O(g)、xmol H2(g)和0.5mol CO2(g)发生上述反应,要使反应开始时向逆反应方向进行,x的取值范围是x>4.
(3)若反应器绝热,判断该反应达到平衡状态的标志是①④(填序号)
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各组分的物质的量浓度不再改变
⑤消耗1mol H2O(g)的同时,生成1mol CO2(g)
(4)如图表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度变化的情况,图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).
 在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:
在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(2)830℃时,向反应器中投入1mol CO(g)、2mol H2O(g)、xmol H2(g)和0.5mol CO2(g)发生上述反应,要使反应开始时向逆反应方向进行,x的取值范围是x>4.
(3)若反应器绝热,判断该反应达到平衡状态的标志是①④(填序号)
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各组分的物质的量浓度不再改变
⑤消耗1mol H2O(g)的同时,生成1mol CO2(g)
(4)如图表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度变化的情况,图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).
8.下列反应的离子方程式书写错误的是( )
| A. | 盐酸跟氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 硝酸跟碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| C. | 氯化钠溶液跟硝酸银溶液反应:Ag++Cl-═AgCl↓ | |
| D. | 盐酸跟氢氧化铜反应:H++OH-═H2O |
6.某卡车在启动、刹车时排出大量浓烟,由此可以判断此卡车所用的燃料是( )
| A. | 酒精 | B. | 汽油 | C. | 柴油 | D. | 液化石油气 |
 和
和
 和
和

