题目内容
下列说法正确的是( )
| A、同温同压下,等质量的甲烷比氖气所占有的体积小 |
| B、3.01×1023个X气体分子的质量为16g,则X气体的摩尔质量是64g/mol |
| C、0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl-的数目之比为15:2 |
| D、100ml 1mol/L NaCl溶液与50ml 1mol/L AlCl3溶液中Cl-物质的量浓度相等 |
考点:物质的量的相关计算
专题:计算题
分析:A.同温同压下,相同质量的气体,其体积与摩尔质量成反比,摩尔质量越大,占有的体积越小;
B.3.01×1023个X气体分子的物质的量是0.5mol,根据n=
计算可知;
C.根据溶质化学式计算结合n=cv计算各溶液中的Cl-物质的量,然后求比值;
D.根据溶液中氯离子的物质的量浓度=盐的浓度×化学式中氯离子个数,求出各溶液中Cl-的物质的量浓度,然后求比值;
B.3.01×1023个X气体分子的物质的量是0.5mol,根据n=
| m |
| M |
C.根据溶质化学式计算结合n=cv计算各溶液中的Cl-物质的量,然后求比值;
D.根据溶液中氯离子的物质的量浓度=盐的浓度×化学式中氯离子个数,求出各溶液中Cl-的物质的量浓度,然后求比值;
解答:
解:A.同温同压下,气体摩尔体积相等,根据V=
Vm知,质量相同时,气体体积与气体摩尔质量成反比,甲烷的摩尔质量是16g/mol,氖的摩尔质量是20g/mol,所以甲烷比氖气所占有的体积大,故A错误;
B.3.01×1023个X气体分子的物质的量=
=0.5mol,X气体的摩尔质量M=
=
=32g/mol,故B错误;
C.0.5L 1mol?L-1 FeCl3溶液中Cl-的物质的量为1mol?L-1×3×0.5L=1.5mol,0.2L 1mol?L-1 KCl溶液中Cl-的物质的量为1mol?L-1×0.2L=0.2mol,Cl-的物质的量之比为15:2,故C正确;
D.100ml 1mol/L NaCl溶液中Cl-浓度为1mol/L,50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L,两者Cl-物质的量浓度不相等,故D错误;
故选C.
| m |
| M |
B.3.01×1023个X气体分子的物质的量=
| 3.01×1023 |
| 6.02×1023 |
| m |
| n |
| 16g |
| 0.5mol |
C.0.5L 1mol?L-1 FeCl3溶液中Cl-的物质的量为1mol?L-1×3×0.5L=1.5mol,0.2L 1mol?L-1 KCl溶液中Cl-的物质的量为1mol?L-1×0.2L=0.2mol,Cl-的物质的量之比为15:2,故C正确;
D.100ml 1mol/L NaCl溶液中Cl-浓度为1mol/L,50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L,两者Cl-物质的量浓度不相等,故D错误;
故选C.
点评:本题考查物质的量的计算与理解,题目难度不大,注意溶液中溶质离子的物质的量与溶液体积的关系,注意同温同压下,气体的物质的量越多,则气体的体积越大.

练习册系列答案
相关题目
在80g密度为dg/cm3的硫酸铁溶液中,含有2.8gFe3+,则此溶液中SO42-的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列说法正确的是( )
| A、Si、P、S、Cl相应的最高价氧化物对应水化物的酸性依次增强 |
| B、自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 |
| C、工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质 |
| D、金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜 |
下列叙述正确的是( )
| A、工业上用氯气通入纯碱溶液来生产漂白粉 | ||||
B、工业制硫酸的生产过程中,硫元素的转化步骤是:FeS2
| ||||
| C、高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 | ||||
| D、在海水中加人石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法 |
下列说法错误的是( )
| A、向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ |
| B、“血液渗析”利用了胶体的性质 |
| C、沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
| D、工农业生产中的土壤保肥、冶金选矿、原油脱水、高压除尘等都与胶体的性质有关 |
下列有关化学用语正确的是( )
①乙烯的最简式C2H4
②乙醛的结构简式CH3COH
③四氯化碳的电子式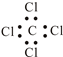
④乙烷的结构式CH3CH3.
①乙烯的最简式C2H4
②乙醛的结构简式CH3COH
③四氯化碳的电子式

④乙烷的结构式CH3CH3.
| A、全对 | B、全错 | C、①② | D、③④ |