题目内容
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ?moL-1
2H2(g)+O2(g)=2H2O(g);△H=-483.6KJ?moL-1
H2O (g)=H2O(l);△H=-44.0KJ?moL-1
(1)氢气的燃烧热△H= kJ?moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其正极的电极反应式是 某氢氧燃料电池释放228.64kJ电能时,生成1mol液态水,该电池的能量转化率为 .
(4)在25℃时,以氢氧燃料电池为电源,用石墨电极电解400mL一定浓度的CuSO4溶液.5min后停止通电,在一个石墨电极上有1.28g Cu生成,且两极生成体积相同的气体.试回答下列问题:
①总反应式为 .
②电解过程中转移的电子数为 mol,同时生成标准状况下气体的体积为 .
③电解后溶液的PH= (不考虑溶液体积变化).
④若要使电解质溶液复原,应加入 mol 的 .
2H2(g)+O2(g)=2H2O(g);△H=-483.6KJ?moL-1
H2O (g)=H2O(l);△H=-44.0KJ?moL-1
(1)氢气的燃烧热△H=
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其正极的电极反应式是
(4)在25℃时,以氢氧燃料电池为电源,用石墨电极电解400mL一定浓度的CuSO4溶液.5min后停止通电,在一个石墨电极上有1.28g Cu生成,且两极生成体积相同的气体.试回答下列问题:
①总反应式为
②电解过程中转移的电子数为
③电解后溶液的PH=
④若要使电解质溶液复原,应加入
考点:反应热和焓变,热化学方程式,常见化学电源的种类及其工作原理,电解原理
专题:基本概念与基本理论
分析:(1)通常条件下,1mol氢气完全燃烧生成液态水放出的热量为氢气的燃烧热.利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减,据此书写判断;
(2)利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;利用2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol结合盖斯定律来写出CO和 H2O(g)作用生成CO2和H2的热化学方程式;
(3)原电池负极发生氧化反应,氢气在负极放电,正极上是氧气得电子的还原反应,根据电极反应计算;
(4)据电解池的电解原理来书写电解反应方程式;根据阴极反应计算当有1.28g Cu生成时,反应所转移的电子数,两极上转移电子相等计算阳极上得到气体的物质的量,结合标准状况气体摩尔体积计算体积以及溶液的pH,电解质复原遵循:“出什么加什么”的原则.
(2)利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;利用2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol结合盖斯定律来写出CO和 H2O(g)作用生成CO2和H2的热化学方程式;
(3)原电池负极发生氧化反应,氢气在负极放电,正极上是氧气得电子的还原反应,根据电极反应计算;
(4)据电解池的电解原理来书写电解反应方程式;根据阴极反应计算当有1.28g Cu生成时,反应所转移的电子数,两极上转移电子相等计算阳极上得到气体的物质的量,结合标准状况气体摩尔体积计算体积以及溶液的pH,电解质复原遵循:“出什么加什么”的原则.
解答:
解:(1)已知:①2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1
②H2O (g)=H2O(l)△H=-44.0KJ?moL-1
根据盖斯定律,①×
+②得H2(g)+
O2(g)=H2O(l)△H=
×(-483.6KJ?moL-1)+(-44.0KJ?moL-1)=-285.8KJ?moL-1;
故答案为:-285.8;
(2)已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ?moL-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1
根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g)△H=-566kJ?moL-1-(-483.6KJ?moL-1)=-82.4KJ?moL-1.
即CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1.
故答案为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1;
(3)在氢氧燃料电池的正极上发生得电子的反应,即O2+2H2O+4e-═4OH-,H2(g)+
O2(g)=H2O(l)△H=-285.8KJ?moL-1,氢氧燃料电池释放228.64kJ电能时,生成1mol液态水,该电池的能量转化率为
×100%=80%,故答案为:80%;
(4)①电解硫酸铜时,阳极上是氢氧根放电,阴极上是铜离子放电,
电解原理方程式为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
②电解硫酸铜时,阴极上是铜离子先放电,两极生成体积相同的气体,即阴极上:Cu2++2e-→Cu,2H++2e-→H2↑,当该电极上有1.28g Cu生成时,转移电子为
×2=0.04mol,阳极上是氢氧根放电,即4OH-→O2↑+2H2O+4e-,当两极生成体积相同的气体时,则转移电子是一样的,所以共转移0.08mol电子,此时阴极上产生氢气是0.02mol,阳极上产生氧气是0.02mol,两极上生成标准状况下气体的体积为0.04mol×22.4L/mol=0.896L,
故答案为:0.08;0.896L;
③根据电极反应:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,该反应转移电子4mol,当转移0.08mol电子时,生成硫酸的物质的量是0.04mol,氢离子浓度是
=0.2mol/L,所以pH=1-lg2=0.7,
故答案为:0.7;
④电解的实质是生成金属铜额、氢气和氧气,所以需要加入氢氧化铜,根据Cu元素守恒,析出0.02mol金属铜,所以要加入0.02molCu(OH)2,
故答案为:0.02;Cu(OH)2.
②H2O (g)=H2O(l)△H=-44.0KJ?moL-1
根据盖斯定律,①×
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-285.8;
(2)已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ?moL-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1
根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g)△H=-566kJ?moL-1-(-483.6KJ?moL-1)=-82.4KJ?moL-1.
即CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1.
故答案为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1;
(3)在氢氧燃料电池的正极上发生得电子的反应,即O2+2H2O+4e-═4OH-,H2(g)+
| 1 |
| 2 |
| 228.64 |
| 285.8 |
(4)①电解硫酸铜时,阳极上是氢氧根放电,阴极上是铜离子放电,
电解原理方程式为:2CuSO4+2H2O
| ||
故答案为:2CuSO4+2H2O
| ||
②电解硫酸铜时,阴极上是铜离子先放电,两极生成体积相同的气体,即阴极上:Cu2++2e-→Cu,2H++2e-→H2↑,当该电极上有1.28g Cu生成时,转移电子为
| 1.28g |
| 64g/mol |
故答案为:0.08;0.896L;
③根据电极反应:2CuSO4+2H2O
| ||
| 0.04mol×2 |
| 0.4L |
=0.2mol/L,所以pH=1-lg2=0.7,
故答案为:0.7;
④电解的实质是生成金属铜额、氢气和氧气,所以需要加入氢氧化铜,根据Cu元素守恒,析出0.02mol金属铜,所以要加入0.02molCu(OH)2,
故答案为:0.02;Cu(OH)2.
点评:本题综合考查学生热化学:盖斯定律的应用、电化学:燃料电池和电解池的工作原等知识,属于综合知识的考查题,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
常温下,某无色溶液中由水电离产生的c(H+)=10-12mol/L,则此溶液中一定能大量共存的离子组是( )
| A、Mg2+、NH4+、K+、SO42- |
| B、Na+、S2O32-、OH-、Br- |
| C、Na+、K+、NO3-、SO42- |
| D、K+、Cr2O72-、NO3-、Cl- |
 1999年比利时发生奶粉受二噁英污染事件.二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图.下列说法中不正确的是( )
1999年比利时发生奶粉受二噁英污染事件.二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图.下列说法中不正确的是( )| A、它的分子式为C12H4O2Cl4 |
| B、它的一溴取代物有一种 |
| C、它能发生取代反应 |
| D、此分子中共平面的原子最多有18个 |
“钴酞菁(分子直径1.3×10-9m)”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似,我国科学家在世界上第一次为“钴酞菁”分子恢复了磁性.下列关于“钴酞菁”的说法正确的是( )
| A、在水中形成的分散系属于悬浊液 |
| B、分子直径比Na+小 |
| C、“钴酞菁”分子不能透过滤纸 |
| D、在水中形成的分散系具有丁达尔效应 |
把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的体积为( )
| A、11.2升 |
| B、67.2升 |
| C、4.48升 |
| D、33.6升 |
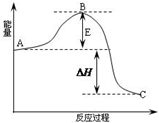 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题: