题目内容
下列物质中由于水解使溶液的pH小于7的是( )
| A、NaHCO3 |
| B、NH4Cl |
| C、Na2SO4 |
| D、NaHSO4 |
考点:盐类水解的应用
专题:盐类的水解专题
分析:由于水解使溶液的pH小于7,说明该物质是强酸弱碱盐,据此分析解答.
解答:
解:A.碳酸氢钠中碳酸氢根离子水解程度大于电离程度,所以其溶液呈碱性,pH>7,故A错误;
B.氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,所以pH<7,故B正确;
C.硫酸钠为强酸强碱盐,钠离子和硫酸根离子都不水解,所以溶液的pH=7,故C错误;
D.硫酸氢钠是强酸酸式盐,硫酸氢钠完全电离生成氢离子导致溶液呈强酸性,其溶液pH<7,故D错误;
故选B.
B.氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,所以pH<7,故B正确;
C.硫酸钠为强酸强碱盐,钠离子和硫酸根离子都不水解,所以溶液的pH=7,故C错误;
D.硫酸氢钠是强酸酸式盐,硫酸氢钠完全电离生成氢离子导致溶液呈强酸性,其溶液pH<7,故D错误;
故选B.
点评:本题考查了盐类水解,根据“谁强谁显性、谁弱谁水解”来确定溶液酸碱性,注意AD中电离方式的区别,为易错点.

练习册系列答案
相关题目
下列递变规律正确的是( )
| A、KOH、Ca (OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
| B、Na、Mg、Al、Si的金属性逐渐增强 |
| C、HF、HCl、H2S、PH3的稳定性依次增强 |
| D、O、S、Na、K的原子半径依次增大 |
萃取碘水中的碘,可用的萃取剂是 ①四氯化碳 ②酒精 ③苯( )
| A、只有① | B、①和③ |
| C、①和② | D、①②③ |
下列离子方程式书写正确的是( )
| A、硫酸镁与氢氧化钾反应:MgSO4+2OH-=Mg(OH)2↓+SO42- |
| B、氧化铜与稀硫酸反应:O2-+2H+=H2O |
| C、碳酸钙与醋酸反应:CO32-+2H+=CO2↑+H2O |
| D、氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O |
已知可逆反应mA(g)+nB(g)?xC(g) 在某一时刻的反应速率为:v(A)=a mol?L-1?min-1,
v(B)=b mol?L-1?min-1,v(C)=c mol?L-1?min-1,则x的值为( )
v(B)=b mol?L-1?min-1,v(C)=c mol?L-1?min-1,则x的值为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
某有机物的键线式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A、不溶于水 |
| B、属于芳香族化合物 |
| C、在加热和催化剂作用下,最多能和4mol H2反应 |
| D、既能发生氧化反应也能发生加聚反应 |
以下原子轨道符号不正确的是( )
| A、1s | B、3d | C、2f | D、2p |
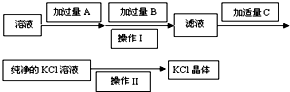 为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作: A、B、C和铜关系如图:
A、B、C和铜关系如图: