题目内容
下列离子方程式错误的是( )
| A、氨气通入稀硫酸:NH3+H+=NH4+ |
| B、稀氢氧化钠溶液和氯化铵溶液混合:NH4++OH-=NH3?H2O |
| C、碳酸氢铵和少量浓氢氧化钠溶液混合:NH4++OH-=NH3↑+H2O |
| D、Cl2和水反应:Cl2+H2O?H++Cl-+HClO |
考点:离子方程式的书写
专题:离子反应专题
分析:A.少量氨气和稀硫酸反应生成硫酸铵;
B.稀氢氧化钠溶液和氯化铵反应生成氯化钠和一水合氨;
C.碳酸氢铵和浓氢氧化钠溶液混合生成碳酸钠、碳酸铵和水;
D.氯气和水反应生成盐酸和次氯酸.
B.稀氢氧化钠溶液和氯化铵反应生成氯化钠和一水合氨;
C.碳酸氢铵和浓氢氧化钠溶液混合生成碳酸钠、碳酸铵和水;
D.氯气和水反应生成盐酸和次氯酸.
解答:
解:A.少量氨气和稀硫酸反应生成硫酸铵,离子方程式为NH3+H+=NH4+,故A正确;
B.稀氢氧化钠溶液和氯化铵反应生成氯化钠和一水合氨,离子方程式为NH4++OH-=NH3?H2O,故B正确;
C.碳酸氢铵和少量浓氢氧化钠溶液混合生成碳酸钠、碳酸铵和水,离子方程式为HCO3-+OH-=CO32-+H2O,故C错误;
D.氯气和水反应生成盐酸和次氯酸,离子方程式为Cl2+H2O?H++Cl-+HClO,故D正确;
故选C.
B.稀氢氧化钠溶液和氯化铵反应生成氯化钠和一水合氨,离子方程式为NH4++OH-=NH3?H2O,故B正确;
C.碳酸氢铵和少量浓氢氧化钠溶液混合生成碳酸钠、碳酸铵和水,离子方程式为HCO3-+OH-=CO32-+H2O,故C错误;
D.氯气和水反应生成盐酸和次氯酸,离子方程式为Cl2+H2O?H++Cl-+HClO,故D正确;
故选C.
点评:本题考查了离子方程式的书写,明确离子方程式书写规则及发生的反应是解本题关键,注意BC选项的区别,B中反应的先后顺序为解答的易错点.

练习册系列答案
相关题目
高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A、放电时正极反应为:Zn-2e-+2OH-═Zn(OH)2 |
| B、该原电池,Zn作正极,可用石墨等作负极 |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、放电时正极附近溶液的碱性增强 |
某酯的分子式为Cn+4H2n+6O2,它是分子式为CnH2nO的X与有机物Y反应的生成物.有关X、Y的说法正确的是( )
| A、X中一定含有两种官能团:羟基和碳碳双键 |
| B、Y的分子式为C4H6O2,其可能结构有3种 |
| C、Y的分子式为C4H8O2,其属于酯类的结构有4种 |
| D、X和Y都能和碳酸氢钠反应,产生二氧化碳气体 |
下列说法正确的是( )
| A、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| B、使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 |
| C、检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| D、用10mL量筒量取9.2mL NaCl溶液 |
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A、5.6g铁与足量的Cl2反应失去电子数为0.2NA个 |
| B、1mol NH3中共价键总数为3NA |
| C、1.5mol NO2与足量H2O反应,转移的电子数为2NA |
| D、标况下22.4LO2和O3组成的混合物中总原子数为2NA个 |
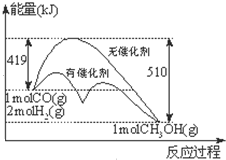 反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )| A、达到平衡时,升高温度,CO的转化率减小 |
| B、1mol CO(g)和2mol H2(g)在密闭容器中反应,达平衡时,放出的热量为91KJ |
| C、相同条件下,1mol CO(g)和2mol H2(g)完全反应生成1mol液态CH3OH放出的热量大于91KJ |
| D、反应热取决于反应物总能量与生成物总能量的相对大小,与反应发生的条件无关 |
把一定量的锌与100mL 18.5mol/L的浓硫酸充分反应后,锌完全溶解,同时生成标准状况下 33.6L的气体,将反应后的溶液稀释到1L,测得溶液的pH=1,则下列叙述错误的是( )
| A、气体A中SO2和H2的体积比为4:1 |
| B、气体A是SO2和H2的混合物 |
| C、反应中共消耗锌97.5g |
| D、反应中共转移电子3 mol |
下列除杂质的操作中不正确的是( )
| A、NaHCO3溶液中混有少量Na2CO3:往该溶液中加入过量Ca(HCO3)2溶液 |
| B、CO2中混有HCl:将其通入饱和NaHCO3溶液 |
| C、铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤 |
| D、NaCl固体中混有少量I2:充分加热 |