题目内容
3.将0.4g NaOH和1.06g Na2CO3合并配成溶液,向溶液中滴加0.lmol•L-l的盐酸.下图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )| A. |  | B. | 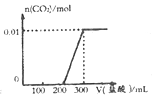 | ||
| C. |  | D. | 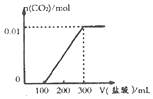 |
分析 0.4g NaOH的物质的量为$\frac{0.4g}{40g/mol}$=0.01mol,1.06g Na2C03的物质的量为$\frac{1.06g}{106g/mol}$=0.01mol,向NaOH和混合溶液中滴加0.1mol•L-1的盐酸,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象解答该题.
解答 解:A.加入0.1L盐酸,n(HCl)=0.1L×0.1mol/L=0.01mol,0.01mol盐酸与氢氧化钠反应没有气体生成,再加入0.01molHCl,与0.01mol碳酸钠恰好反应生成碳酸氢钠,也没有气体生成,则图象与实际不符,故A错误;
B.向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,此时开始放出气体,再消耗0.1L盐酸,生成二氧化碳达最大,图象与实际相符合,故B正确;
C.图象中开始反应即有气体生成,与反应不符,故C错误;
D.因碳酸钠与盐酸的反应分步完成,则碳酸钠与盐酸先反应生成碳酸氢钠和氯化钠,此时没有气体生成,则图象与反应不符,故D错误;
故选B.
点评 本题考查了元素化合物、图象数据的处理知识,为高频考点,侧重考查学生的分析能力,解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑.

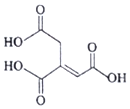
| A. | 化学式为C6H6O6 | |
| B. | 乌头酸含有三种官能团 | |
| C. | 乌头酸能使酸性高锰酸钾溶液褪色 | |
| D. | 含l mol乌头酸的溶液最多可消耗3 mol NaOH |
| A. | CO2的摩尔质量是44g | |
| B. | 1mol CO2的体积约为22.4L | |
| C. | 1mol CO2的质量是44g/mol | |
| D. | 1mol CO2中所含分子数约为6.02×1023个 |
| A. | 硅元素在自然界里均以化合态存在 | |
| B. | SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2=Si+CO2↑ |
 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..(1)①仪器c的名称是球形干燥管.
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b(选填“a”、“b”或“a 和 b”).
(2)装置A中Cu(NO3)2•3H2O和SOC12发生反应的化学方程式是Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCI↑.
(3)装置B的作用是吸收SO2和HCl,防止倒吸.
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2•3H2O的实验方案如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稍过量稀HNO_{3}}$溶液Ⅰ→…→Cu(NO3)2•3HO2晶体
己知几种离子生成氢氧化物沉淀的pH如表
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
②请补充完整由溶液I制备Cu(NO3)2•3H2O晶体的实验方案:向溶液I中加入Cu(OH)2或Cu2(OH)2CO3至溶液3.2<pH<4.2,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤,冰水洗涤得到Cu(NO3)2•3H2O晶体.
2C(s)+O2(g)═2CO(g),△H=-220.6kJ•mol-1
2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ•mol-1
C(s)+H2O(g)═CO(g)+H2(g),△H=akJ•mol-1
则 a 为( )
| A. | ?263 | B. | +263 | C. | ?352.1 | D. | +131.5 |

(1)在海洋中化石燃料转化为地质碳酸盐的过程中发生的反应类型有化合反应或氧化反应或裂解反应.
(2)光合作用是把无机物转化为有机物的同时,还能把光能转化为化学能.
(3)化石燃料最终转化为CO2,要使化石燃料充分燃烧,需测定煤或石油中的含碳量:将a g的样品进行充分燃烧,测定所得气体 ( CO2、SO2、NO2、N2、O2 ) 中CO2的含量.实验装置如图1所示 ( 所用试剂均过量 ):
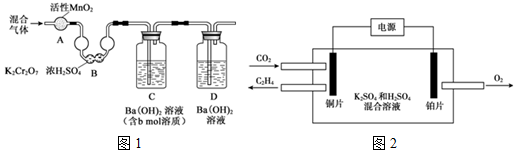
①混合气体通过A和B的目的是除去SO2、NO2,防止对Ba(OH)2吸收CO2造成干扰
②装置D的作用是防止空气中的CO2进入装置C,造成测碳量产生误差
③实验结束后,还需要向装置中通入N2,其目的是将装置A、B中的气体赶入装置C中,确保CO2被完全吸收.
④用x mol/L HCl溶液滴定装置C中过量的Ba(OH)2,消耗y mLHCl溶液,a g样品中碳元素的质量分数为$\frac{(b-\frac{1}{2}xy×1{0}^{-3})×12}{a}$×100%(列出计算式).
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见表. ( t1 <t2 <t3 )
| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
②能证明该反应在t2时刻达到化学平衡的是a c(选填字母).
a.容器内压强不再变化 b.容器内 NH3、CO2物质的量比为 2:1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗NH3速率相等
(5)用一种钾盐的酸性水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图2).铂电极是阳(填“阴”或“阳”)极;在铜极上产生乙烯的电极反应式是2CO2+12H++12e -═C2H4+4H2O.
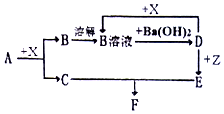 下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略)
下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略) .
.