题目内容
11.下列有关有机物的说法中①结构片段为…
 …的高聚物,其单体是甲醛和苯酚
…的高聚物,其单体是甲醛和苯酚②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应:

⑤
 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有( )个.
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
分析 ① 为酚醛树脂;
为酚醛树脂;
②标准状况下,HF为液态;
③甲醇通常是液体;
④苯酚和碳酸钠溶液反应生成苯酚钠和碳酸氢钠;
⑤ 主链含有5个C原子,有3个甲基;
主链含有5个C原子,有3个甲基;
⑥碳碳双键具有平面形结构,结合三点确定一个平面判断;
⑦苯与苯甲酸的分子式可分别写为C6H6、C6H6•CO2.
解答 解:① 为酚醛树脂,单体是甲醛和苯酚,故正确;
为酚醛树脂,单体是甲醛和苯酚,故正确;
②标准状况下,HF为液态,22.4L不是1mol,故错误;
③甲醇通常是液体,故错误;
④苯酚和碳酸钠溶液反应生成苯酚钠和碳酸氢钠,则方程式正确,故正确;
⑤ 主链含有5个C原子,有3个甲基,名称为2,4,4,-三甲基-1-戊烯,故正确;
主链含有5个C原子,有3个甲基,名称为2,4,4,-三甲基-1-戊烯,故正确;
⑥碳碳双键具有平面形结构,结合三点确定一个平面判断,5个C原子可能处于同一平面,故错误;
⑦苯与苯甲酸的分子式可分别写为C6H6、C6H6•CO2,则等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等,故正确.
故选A.
点评 本题综合考查有机物的组成、结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的组成、结构和官能团的性质,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.检验乙烯中的二氧化硫气体,下列试剂不能达到目的是( )
| A. | 品红溶液 | B. | 澄清石灰水 | C. | 酸性KMnO4溶液 | D. | 石蕊溶液 |
19.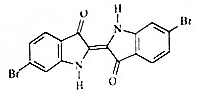 地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
 地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )| A. | 属于烃的衍生物 | |
| B. | 分子式为C16H8O2N2Br2 | |
| C. | 1mol该有机物与H2加成最多消耗9molH2 | |
| D. | 该有机物溴元素检验可将有机物与碱液共热后,直接加入硝酸银溶液,观察是否有浅黄色沉淀生成. |
20.下列物质用加热的方法可分离的是( )
| A. | 氯化铵和消石灰固体 | B. | 碳酸氢铵和过氧化钠固体 | ||
| C. | 碘化钾和碘晶体 | D. | 硝酸钾与食盐晶体 |
1.下列有关材料的说法错误的是( )
| A. | 铁制品在潮湿空气中更易锈蚀 | |
| B. | 二氧化硅常用于制造光导纤维 | |
| C. | 实验室中经过滤可得到纳米碳酸钙固体 | |
| D. | 聚乙烯可作食品包装材料 |