题目内容
 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.(1)CaC2中
| C | 2- 2 |
| O | 2+ 2 |
| O | 2+ 2 |
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀.Cu+基态核外电子排布式为
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有哑铃形
| C | 2- 2 |
| C | 2- 2 |
考点:晶胞的计算,原子核外电子排布
专题:化学键与晶体结构
分析:(1)等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;
(2)Cu为29号元素,Cu+的基态电子排布式为1s22s22p63s23p63d10;
(3)丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;
(4)晶胞的一个平面的长与宽不相等,所以1个Ca2+周围距离最近的C22-有4个,而不是6个.
(2)Cu为29号元素,Cu+的基态电子排布式为1s22s22p63s23p63d10;
(3)丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;
(4)晶胞的一个平面的长与宽不相等,所以1个Ca2+周围距离最近的C22-有4个,而不是6个.
解答:
解:(1)根据等电子体原理可知,O22+的电子式为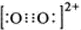 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:2NA;
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:2NA;
(2)Cu为29号元素,要注意3d轨道写在4s轨道的前面同时还有就是它的3d结构,Cu+的基态电子排布式为1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10;
(3)通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;故答案为:sp杂化、sp2杂化;3;
(4)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,故答案为:4.
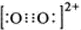 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:2NA;
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:2NA;(2)Cu为29号元素,要注意3d轨道写在4s轨道的前面同时还有就是它的3d结构,Cu+的基态电子排布式为1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10;
(3)通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;故答案为:sp杂化、sp2杂化;3;
(4)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,故答案为:4.
点评:本题考查了学生对等电子体、Cu+基态核外电子排布、原子轨道杂化类型、分子空间结构、NaCl晶体类似的CaC2晶体的晶胞结构、1mol O22+中π键的数目等知识的掌握和应用能力,本题基础性较强,重点特出,材料串联较好.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
设空气中O2体积分数0.25,N2体积分数0.75.有水存在的条件下,氮的氧化物和一定量空气混合恰好完全反应,反应后气体体积减少一半.该氮的氧化物是( )
| A、NO |
| B、NO2 |
| C、NO和NO2物质的量之比为2:1混合物 |
| D、NO和NO2物质的量之比为1:1混合物 |
下列解释物质用途的反应方程式不正确的是( )
| A、用Fe2(SO4)3净水 Fe3++3H2O?Fe(OH)3+3H+ | ||||
| B、用Na2S处理含Hg2+废水 Hg2++S2-═HgS↓ | ||||
| C、用Na2CO3溶液处理水垢中的CaSO4 Ca2++CO32-═CaCO3↓ | ||||
D、燃煤时加入石灰石,减少SO2排放 2CaCO3+2SO2+O2
|



 【化学--物质结构与性质】
【化学--物质结构与性质】