题目内容
16.铝是用途广泛的金属材料,目前工业上主要用铝土矿(主要成分含氧化铝、氧化铁)来制取铝,其常见的过程如下:
请回答下列问题:
(1)沉淀B的化学式为Fe2O3,溶液C中阴离子主要是AlO2-和OH-.
(2)操作Ⅰ是过滤(填操作名称)
(3)写出①过程中发生反应的离子方程式Al2O3+2OH-═2AlO-2+H2O.
(4)Al(OH)3沉淀必须进行洗涤才能通过操作Ⅳ获得纯净Al2O3,操作Ⅳ是灼烧(填操作名称),简述洗涤沉淀的操作方法:在过滤器中加入水至淹没沉淀,等水自然流尽后重复操作2-3次.
(5)电解Al2O3制取金属Al的阴极电极反应式为Al3++3e-=Al.
分析 铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀B为氧化铁,滤液中含氢氧化钠和偏铝酸钠;通入二氧化碳,二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀和碳酸钠,二氧化碳和氢氧化钠反应生成碳酸钠,过滤得到氢氧化铝沉淀和碳酸钠溶液;灼烧氢氧化铝得到氧化铝和水,电解氧化铝得到铝和氧气;碳酸钠溶液和氧化钙反应生成碳酸钙和氢氧化钠,氢氧化钠用来碱浸;灼烧碳酸钙得到氧化钙和二氧化碳,二氧化碳和氧化钙循环使用.
(1)铝土矿中含氧化铁,氧化铁不和碱反应;氧化钙和水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀(E)和氢氧化钠;
(2)不溶物和溶液分开采取过滤的方法;
(3)铝土矿中含有氧化铝,可与氢氧化钠反应生成偏铝酸钠和水;
(4)氢氧化铝受热分解得到氧化铝;洗涤沉淀,可在过滤器中加入水至淹没沉淀,等水过滤后,重复操作2-3次;
(5)电解池中,阴极上是阳离子Al3+发生得电子的还原反应.
解答 解:(1)铝土矿中含氧化铁,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀B为氧化铁,滤液中含氢氧化钠和偏铝酸钠;
故答案为:Fe2O3;AlO2-和OH-;
(2)不溶物和溶液分开采取过滤的方法,氧化铁不和碱反应,为不溶物,氧化铝可与氢氧化钠反应生成偏铝酸钠和水,故用过滤方法把沉淀和溶液分开,
故答案为:过滤;
(3)铝土矿中含有氧化铝,可与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-═2AlO-2+H2O,
故答案为:Al2O3+2OH-═2AlO-2+H2O;
(4)氢氧化铝受热分解得到氧化铝,故操作Ⅳ是灼烧;洗涤沉淀,可在过滤器中加入水至淹没沉淀,等水自然流尽后重复操作2-3次,
故答案为:灼烧;在过滤器中加入水至淹没沉淀,等水自然流尽后重复操作2-3次;
(5)电解池中,阴极上是阳离子Al3+发生得电子的还原反应:Al3++3e-=Al,故答案为:Al3++3e-=Al.
点评 本题考查物质的分离和提纯,侧重于铝的化合物的考查,难度中等,注意把握相关物质的性质以及化学方程式的书写,学习中注意相关知识的积累.

 阅读快车系列答案
阅读快车系列答案| A. | 常温常压下,20g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | 含1mol H2O的冰中,氢键的数目为4NA | |
| D. | 常温常压下,124g P4有P-P键的数目为12NA |
| A. | baedc | B. | edabc | C. | abdce | D. | ebadc |
| A. | 水的电离是一个放热过程 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的盐酸中由水电离产生的c(OH-)=1.0×10-3mol/L | |
| D. | 25℃时,向溶液中加入稀氨水,平衡逆向移动,Kw不变 |
| A. | NaHCO3溶液、NaOH溶液、碱石灰 | B. | Na2CO3溶液、浓硫酸、碱石灰 | ||
| C. | NaHCO3溶液、NaOH溶液、浓硫酸 | D. | NaOH溶液、浓硫酸、碱石灰 |
| A. | 不慎将酒精洒到桌面上引起着火,应立即用较多的水浇灭 | |
| B. | 为防止试管破裂,加热固体时试管口一般要略低于试管底 | |
| C. | 白磷在空气中易自燃,用剩的白磷可倒入垃圾箱 | |
| D. | 蒸馏时为防止液体暴沸可在蒸馏烧瓶中加入少量沸石 |
| 操作和现象 | 结论 | |
| A | 用玻璃棒蘸取某溶液做焰色反应,可看到黄色火焰 | 溶液中一定有Na+ |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| D | 向某溶液中加稀盐酸无现象,再加入BaCl2溶液,生成白色沉淀 | 该溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
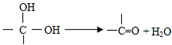 ,如图中X分子式为C4H2Br2O4,为六元环化合物,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰.
,如图中X分子式为C4H2Br2O4,为六元环化合物,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰.
 .它可以发生ab反应(填字母)a、取代 b、消去c、加成
.它可以发生ab反应(填字母)a、取代 b、消去c、加成 .
.