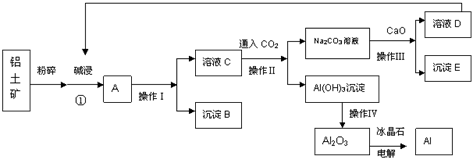
题目内容
7.设NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 常温常压下,20g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | 含1mol H2O的冰中,氢键的数目为4NA | |
| D. | 常温常压下,124g P4有P-P键的数目为12NA |
分析 A、重水的摩尔质量为20g/mol,然后根据1mol重水~0.5mol氢气来分析;
B、过氧化钠与水的反应为歧化反应;
C、1mol冰中存在2mol氢键;
D、求出白磷的物质的量,然后根据1mol白磷中含6molP-P键来分析.
解答 解:A、重水的摩尔质量为20g/mol,故20g重水的为1mol,而1mol重水~0.5mol氢气,故生成的气体分子个数为0.5NA个,故A正确;
B、过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子即NA个,故B错误;
C、冰中水分子的O原子以类似于金刚石中C原子的四面体空间网状结构排列,每2个O原子间都有一个H原子,更靠近H原子的O原子与它形成共价键,另一个与它形成氢键,即每个H原子都形成一个氢键,所以1mol冰中存在2mol氢键,故C错误;
D、124g白磷分子(分子式为P4)的物质的量是$\frac{124g}{124g/mol}$=1mol,白磷是正四面体型结构,分子中含有6个P-P共价键,所以1mol白磷分子中含有6molP-P键,含有P-P共价键数目为6NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,熟练掌握公式的运用和物质的结构是解题关键.

练习册系列答案
相关题目
18.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 8g18O2含有的中子数为5NA | |
| B. | 1molFeI2与足量Cl2氯气充分反应转移的电子数为2NA | |
| C. | 标准状况下22.4LNO与11.2LO2混合后的气体分子数约为NA | |
| D. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
2.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )
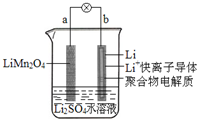

| A. | 理论上外电路中每转移1mol电子,负极消耗的质量为7g | |
| B. | 可以将Li+快离子导体更换成阳离子交换膜,去掉聚合物电解质直接使用Li2SO4水溶液 | |
| C. | 电池放电反应为 Li1-xMn2O4+xLi═LiMn2O4 | |
| D. | 放电时,溶液中的Li+从b向a迁移 |
12.下列有关说法中不正确的是( )
| A. | Al(OH)3在用于治疗胃酸过多类疾病时表现出弱碱性 | |
| B. | 明矾溶于水后可得到少量的有强吸附性的Al(OH)3,故明矾可作净水剂 | |
| C. | Al(OH)3可用于中和馒头制作过程(如发酵阶段)中产生的酸 | |
| D. | Al2O3可用于制作耐火材料而Al(OH)3不能 |
17.某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH${\;}_{4}^{+}$(aq)+$\frac{2}{3}$O2(g)═NO${\;}_{2}^{-}$(aq)+2H+(aq)+H2O(l)△H=-273kJ/mol
②NO${\;}_{2}^{-}$(aq)+$\frac{1}{2}$O2(g)═NO${\;}_{3}^{-}$(aq) H=-73kJ/mol
下列说法正确的是( )
①NH${\;}_{4}^{+}$(aq)+$\frac{2}{3}$O2(g)═NO${\;}_{2}^{-}$(aq)+2H+(aq)+H2O(l)△H=-273kJ/mol
②NO${\;}_{2}^{-}$(aq)+$\frac{1}{2}$O2(g)═NO${\;}_{3}^{-}$(aq) H=-73kJ/mol
下列说法正确的是( )
| A. | 1mol的NH3和1mol的NH4+都有10×6.02×1023个质子 | |
| B. | 室温下,NH4NO2溶液呈酸性,则说明Ka(HNO2)<Kb(NH3•H2O) | |
| C. | NH4+(aq)+2O2(g)═NO3-(aq)+2H+(aq)+H2O(l);△H=-346kJ/mol | |
| D. | 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
 系统命名法命名为5-甲基-4-乙基-3-庚烯
系统命名法命名为5-甲基-4-乙基-3-庚烯 系统命名法命名为1,3二甲基苯
系统命名法命名为1,3二甲基苯 .
.
 在如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞的混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极.在A、B中装满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入铂电极.切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题:
在如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞的混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极.在A、B中装满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入铂电极.切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题: