题目内容
18.以下各条件的改变可确认发生了化学平衡移动的是( )| A. | 由于温度的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 | |
| C. | 化学反应速率发生了改变 | |
| D. | 可逆反应达到平衡后,加入了催化剂 |
分析 可根据化学平衡移动的因素以及可以反应的类型来综合分析,一定条件下,当改变其中一个条件,平衡向减弱这种改变的方向进行;
A、改变温度,平衡一定发生移动;
B、反应前后气体物质的量不变的反应,平衡移动,压强不变;
C、正逆反应速率同等程度改变,平衡不动;
D、催化剂改变反应速率不改变化学平衡.
解答 解:A.改变温度,平衡一定发生移动,故A正确;
B.对于气体总体积反应前后不变的可逆反应(如I2+H2?2HI)来说,无论是否建立平衡,其总物质的量即压强都不会发生变化;对于气体总体积反应前后不等的可逆反应(如2SO2+O2?2SO3)来说,建立化学平衡状态时,总物质的量要与初始时的总物质的量不等,故压强要改变,故B错误;
C.化学反应速率发生改变,未必能说明化学平衡发生了移动,当正反应速率与逆反应速率仍然相等时,化学平衡不会发生移动;当正反应速率与逆反应速率不相等时,化学平衡就会发生移动,故C错误;
D.催化剂只能同等程度地改变正反应速率和逆反应速率,当一个可逆反应建立化学平衡状态后,加入催化剂,正反应速率仍然等于逆反应速率,化学平衡不会发生移动,故D错误;
故选A.
点评 本题要求要能灵活运用影响化学平衡的因素来分思考问题,是对基础知识灵活运用的考查,要求学习时一定要记住并能深刻理解,题目较简单.

练习册系列答案
相关题目
8.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | Cl2 | B. | HCl | C. | BaCO3 | D. | SO2 |
6.下列说法正确的是( )
| A. | SiO2 是酸性氧化物,能与氢氟酸反应 | |
| B. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
13.下列说法正确的是( )
| A. | 铝合金是目前用量最大、用途最广的合金 | |
| B. | 二氧化硫使品红溶液褪色和使溴水褪色的原理相同 | |
| C. | 三种分散系中,胶体的稳定性介于溶液和浊液之间,属于介稳体系 | |
| D. | 活泼金属在空气中易与氧气反应,表面生成一层氧化物,对内部金属都能起保护作用 |
3.将一定量的氯气通入50mL 10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为9﹕5 | |
| C. | 若反应中转移的电子为n mol,则0.20<n<0.30 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
10.YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于89Y的说法正确的是( )
| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | 质子数与中子数之差为50 | |
| D. | 89Y和90Y是两种不同的核素 |
7.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00mol•L-1NaCl溶液中含有Na+的数目为NA | |
| B. | 常压下常温,6.4g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
 氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题:
氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题: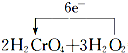 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O