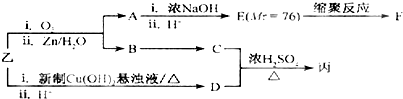
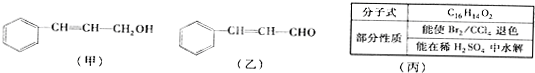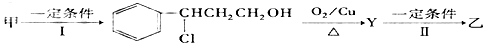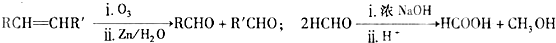题目内容
将6.72L标况下的氯气通入到500ml一定物质的量浓度的氢氧化钠溶液中,恰好完全反应.则
①该氢氧化钠溶液的浓度是多少?
②生成次氯酸钠的质量?
①该氢氧化钠溶液的浓度是多少?
②生成次氯酸钠的质量?
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算氯气的物质的量,根据方程式Cl2+2NaOH=NaCl+NaClO+H2O,计算NaOH的物质的量、生成NaClO的物质的量,根据c=
计算氢氧化钠溶液的浓度,根据m=nM计算次氯酸钠的质量.
| V |
| Vm |
| n |
| V |
解答:
解:①标况下,n(Cl2)=
=0.3mol,
Cl2+2NaOH=NaCl+NaClO+H2O
1 2 1
0.3mol n(NaOH) n(NaClO)
n(NaOH)=
=0.6mol
n(NaClO)=
=0.3mol
①该氢氧化钠溶液的浓度是
=1.2mol/L,
答:该氢氧化钠溶液的浓度为1.2mol/L;
②生成次氯酸钠的质量=0.3mol×74.5g/mol=22.35g,
答:生成次氯酸钠的质量为22.35g.
| 6.72L |
| 22.4L?mol -1 |
Cl2+2NaOH=NaCl+NaClO+H2O
1 2 1
0.3mol n(NaOH) n(NaClO)
n(NaOH)=
| 0.3mol×2 |
| 1 |
n(NaClO)=
| 0.3mol×1 |
| 1 |
①该氢氧化钠溶液的浓度是
| 0.6mol |
| 0.5L |
答:该氢氧化钠溶液的浓度为1.2mol/L;
②生成次氯酸钠的质量=0.3mol×74.5g/mol=22.35g,
答:生成次氯酸钠的质量为22.35g.
点评:本题考查化学方程式的有关计算,比较基础,明确发生的反应是关键,侧重对基础知识的巩固.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法中正确的是( )
| A、对垃圾进行分类要严格执行国际统一的标准 |
| B、对垃圾进行分类的主要目的是便于垃圾的存放 |
| C、凡是废纸都可以归为纸类垃圾进行回收 |
| D、学生在课堂上用过的废纸可以积攒起来进行回收利用 |
分别向下列物质的溶液中加入少量的Na2O2固体,不会出现浑浊的是( )
| A、CuCl2溶液 |
| B、FeCl3溶液 |
| C、饱和Ca(OH)2溶液 |
| D、NaHCO3溶液 |
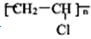 )就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.
)就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.