题目内容
(14分)
(1)25 ℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为
已知25 ℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH=10,溶液中各离子的物质的量浓度由大到小的顺序为 。
(2))若100 ℃时,KW=10-12,则100 ℃时pH=11的Ba(OH)2溶液与pH=2的硫酸按体积比1:9混合充分反应后pH= ;若该温度下10体积的pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系为  。
。
(3)某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示。
该温度下水的离子积为 。该温度下氯化钠溶液的pH为
该温度下0.01 mol/L NaOH溶液的pH为 。
(14分)每空2分
(1)的体积比为 1∶9 浓度由大到小的顺序为 c(Na+)>c(A-) >c(OH-) >c(H+)
(2)pH= 9 ; a与b之间应满足的关系为 a+b="13 "
(3)水的离子积为 10-15 mol2·L-2 pH为 7.5  pH为 13
pH为 13
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
(2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
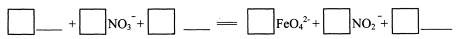
 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=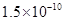
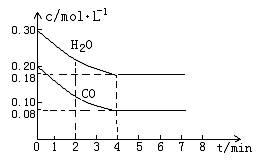
 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

 mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。