题目内容
7. Cu、Ag、Au同为第一副族的元素,它们的性质也有不同之处,如:它们在水溶液中最稳定的氧化态分别为+2,+1和+3,回答下列问题:
Cu、Ag、Au同为第一副族的元素,它们的性质也有不同之处,如:它们在水溶液中最稳定的氧化态分别为+2,+1和+3,回答下列问题:(1)写出Au3+的价层电子排布5d8.
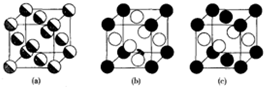
(2)金属固溶体的结构一般与纯金属相同,只是一部分原子被另一部分原子统计的置换了.例如Cu-Au体系,将两种金属混合熔化成液体,当固溶体倍淬火处理,即快速冷却时,形成无序固溶体相,金原子完全统计的取代铜原子,如图(a);另外当合金缓慢地冷却时,两种原子的分布不再无序,在此过程中可以形成两种结构,如图(b)、(c),其中,铜原子和金原子的原子半径分别为128pm、144pm.
说明:(a)中,黑白混搭表示一种无序状态,(b)、(c)中黑球表示Au原子,白球表示Cu原子.
①写出b、c的化学式:bCu3Au、cCuAu.
②试分别求b、c结构的密度:b11.4g/cm3、c12.8g/cm3.
③结合你的理解以及材料,试猜想金、铜能形成金属固溶体的原因:Cu、Au的纯金属结构相同,都为面心立方结构,二者为同一族元素,电子结构相似,为二者原子半径相近.
④若a的密度为14.0g/cm3,试猜想当将a熔化后再缓慢冷却时,得到的物质中b结构和c结构哪个更多?通过计算说明理由.(假定统计原子半径为140pm)
分析 (1)Cu、Ag、Au同为I副族的元素,Au处于第六周期,Au原子外围电子排布为5d106s1,Au原子失去6s能级1个电子、5d能级2个电子形成Au3+;
(2)①根据均摊法计算晶胞中Au、Cu原子数目,进而确定化学式;
②结合晶胞中Au、Cu原子数目计算晶胞质量,(b)为面心立方密堆积,晶胞棱长为(128pm+144pm)×2×$\frac{\sqrt{2}}{2}$=(128pm+144pm)×2×$\frac{\sqrt{2}}{2}$=272$\sqrt{2}$ pm,而(c)8个顶点Au原子也形成立方体,上下两个面中面对角线上的Au原子相邻,则晶胞棱长为144pm×4×$\frac{\sqrt{2}}{2}$=288$\sqrt{2}$ pm,再根据ρ=$\frac{m}{V}$计算晶胞密度;
③Cu、Au的纯金属结构相同,都为面心立方结构,二者为同一族元素,电子结构相似,为二者原子半径相近,金、铜能形成金属固溶体;
④晶胞中原子总数目为4,晶胞棱长为140pm×4×$\frac{\sqrt{2}}{2}$=280$\sqrt{2}$ pm,根据m=ρV计算晶胞质量,进而计算1个原子的质量,再计算NA个原子的质量,即为统计原子的摩尔质量,再计算(b)(c)摩尔质量,对比据此判断.
解答 解:(1)Cu、Ag、Au同为I副族的元素,Au处于第六周期,Au原子外围电子排布为5d106s1,Au原子失去6s能级1个电子、5d能级2个电子形成Au3+,故Au3+的价电子排布为:5d8,
故答案为:5d8;
(2)①(b)中Au原子数目为8×$\frac{1}{8}$=1,Cu原子数目为6×$\frac{1}{2}$=3,故化学式为Cu3Au;
(c)中Au原子数目为8×$\frac{1}{8}$+2×$\frac{1}{2}$=2,Cu原子数目为4×$\frac{1}{2}$=2,故化学式为CuAu,
故答案为:Cu3Au;CuAu;
②(b)为面心立方密堆积,晶胞质量为$\frac{197+64×3}{6.02×1{0}^{23}}$g,晶胞棱长为(128pm+144pm)×2×$\frac{\sqrt{2}}{2}$=(128pm+144pm)×2×$\frac{\sqrt{2}}{2}$=272$\sqrt{2}$ pm,则晶胞密度为$\frac{197+64×3}{6.02×1{0}^{23}}$g÷(272$\sqrt{2}$×10-10cm)3=11.4g/cm3;
(c)晶胞质量为$\frac{2×(197+64)}{6.02×1{0}^{23}}$g,8个顶点Au原子也形成立方体,上下两个面中面对角线上的Au原子相邻,则晶胞棱长为144pm×4×$\frac{\sqrt{2}}{2}$=288$\sqrt{2}$ pm,故晶胞密度为为$\frac{2×(197+64)}{6.02×1{0}^{23}}$g÷(288$\sqrt{2}$×10-10cm)3=12.8g/cm3;
故答案为:11.4g/cm3;12.8g/cm3;
③Cu、Au的纯金属结构相同,都为面心立方结构,二者为同一族元素,电子结构相似,为二者原子半径相近,金、铜能形成金属固溶体;
故答案为:Cu、Au的纯金属结构相同,都为面心立方结构,二者为同一族元素,电子结构相似,为二者原子半径相近;
④(b)中Au与Cu原子为1:3,摩尔质量为$\frac{197+64×3}{1+3}$g/mol=97.25g/mol,(c)中Au、Cu原子1:1,摩尔质量为$\frac{197+64}{1+1}$g/mol=130.5,晶胞中原子总数目为4,晶胞棱长为140pm×4×$\frac{\sqrt{2}}{2}$=280$\sqrt{2}$ pm,则统计原子的摩尔质量为6.02×1023×mol-1×{(280$\sqrt{2}$×10-10cm)3×14.0g/cm3]÷4}=130.8g/mol,而(b)中摩尔质量为$\frac{197+64×3}{1+3}$g/mol=97.25g/mol,故与(c)中数据接近,故得到(c)的结构偏多,
答:得到(c)的结构偏多.
点评 本题考查晶胞计算,需要是具备一定的数学计算能力,题目数据复杂、计算量大,属于易错题目,难度较大.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
| A. | 0.1mol桶烯完全燃烧需要消耗氧气22.4L | |
| B. | 桶烯在一定条件下能发生加成反应,不能发生加聚反应 | |
| C. | 桶烯二氯取代产物只有三种 | |
| D. | 桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体 |
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
| A. | 电解、电镀、电化学腐蚀都需要通电才可进行 | |
| B. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| C. | 浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 | |
| D. | 氢氧化铝可以中和过多的胃酸 |
| A. | NO和O2 | B. | CH4和NH4+ | C. | NH2?和H2O2 | D. | HCl和H2O |
| A. | NaBr和NaI | B. | NaCl | C. | NaBr和NaCl | D. | NaCl和 I2 |
| A. | 硝酸的标签上应标注 和 和 | B. | 硫离子结构示意图: | ||
| C. | HClO的电子式: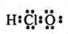 | D. | 239Pu比235U原子核内多4个中子 |