题目内容
15.下列说法正确的是( )| A. | 电解、电镀、电化学腐蚀都需要通电才可进行 | |
| B. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| C. | 浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 | |
| D. | 氢氧化铝可以中和过多的胃酸 |
分析 A.电化学腐蚀发生的是原电池反应,不需要通电;
B.三氧化二铝为两性氢氧化物;
C.浓硫酸具有酸性和脱水性,能将pH试纸碳化;
D.氢氧化铝碱性较弱,能够与盐酸反应,消耗盐酸.
解答 解:A.电解、电镀都需要通电才能进行,电化学腐蚀符合原电池原理,不需要通电即可进行,故A错误;
B.Fe、Cu对应的氧化物均为碱性氧化物,铝对应的氧化物为两性氧化物,故B错误;
C.浓硫酸具有酸性和脱水性,将浓硫酸滴在pH试纸上会出现先变红后变黑现象,故C错误;
D.氢氧化铝碱性较弱,能够与盐酸反应,消耗盐酸,可以中和过多的胃酸,故D正确;
故选:D.
点评 本题考查了元素化合物知识,明确电解池、原电池工作原理、熟悉浓硫酸的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
5.已知反应A2(g)+2B2(g)?2AB2(g)△H<0,下列说法正确的( )
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 | |
| C. | 若反应在密闭体系内进行,通入He气,体系压强增大,反应速率增大 | |
| D. | 若反应在恒压体系内进行,通往He气,体系压强不变,反应速率不变 |
3.分子式为C3H7OCl,且分子含有烃基的同分异构体的数目为(不考虑立体异构)( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
10.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之积与L层的电子数相同.则下列判断不正确的是( )
| A. | 乙元素的族序数比甲元素的族序数大 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序:甲>丙 | |
| C. | 原子半径由大到小的顺序:丙>甲>乙 | |
| D. | 含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
20.下列离子晶体中,熔点最低的是( )
| A. | NaCl | B. | KCl | C. | CaO | D. | MgO |
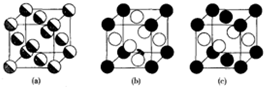 Cu、Ag、Au同为第一副族的元素,它们的性质也有不同之处,如:它们在水溶液中最稳定的氧化态分别为+2,+1和+3,回答下列问题:
Cu、Ag、Au同为第一副族的元素,它们的性质也有不同之处,如:它们在水溶液中最稳定的氧化态分别为+2,+1和+3,回答下列问题: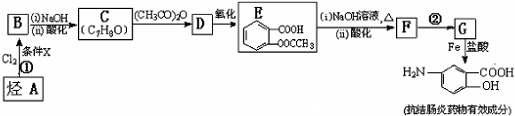
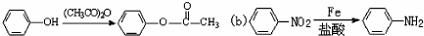
 ;
; ;
;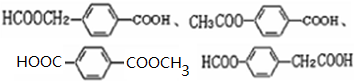 ;
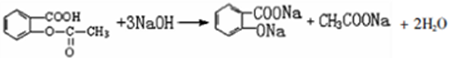
;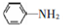 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物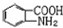 的合成路线
的合成路线 ..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
 .
.