题目内容
【题目】(1)已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.01mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____________沉淀(填化学式),生成该沉淀的离子方程式为______________,当两种沉淀共存时,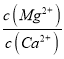 __________(保留两位有效数字)。
__________(保留两位有效数字)。
(2)25℃时,向0.01mol/L的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为____________;当溶液中的离子浓度小于1×10-5mol/L时,认为该离子沉淀完全,当Mg2+完成沉淀时,溶液的pH为___________ (忽略溶液体积的变化,已知:![]() 。
。
(3)该温度下,反应Cu(OH)2+2H+![]() Cu2++2H2O的平衡常数K=_____________。
Cu2++2H2O的平衡常数K=_____________。
【答案】Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ 8.2×108 9.6 11.1 2.2×108
【解析】
(1)根据Ksp的含义:Ksp越小越容易生成沉淀,结合铜盐和碱之间的复分解反应来回答;
(2)已知c(MgCl2)=0.01mol/L,逐滴加入NaOH溶液,刚好出现沉淀时,c(Mg2+)=0.01mol/L,依据Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)计算c(OH-),然后根据Kw=1.0×10-14计算c(H+);当Mg2+完全沉淀时,可根据Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)计算c(OH-),然后根据Kw=1.0×10-14计算c(H+),进而计算pH,当溶液中离子浓度小于1.0×10-5认为沉淀完全;
(3)用离子浓度表示平衡常数表达式,并根据c(H+) 、c(OH-)与Kw关系带入式子,整理可得得该反应的化学平衡常数。
(1)难溶性物质Mg(OH)2、Cu(OH)2构型相同,对于构型相同的物质来说,Ksp的越小,越容易生成沉淀,由于Cu(OH)2的溶度积常数小于Mg(OH)2的溶度积常数,所以先生成沉淀Cu(OH)2沉淀;CuCl2溶液中加入氨水,反应产生氢氧化铜沉淀和NH4Cl,反应的离子方程式为:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+;
当两种沉淀共存时, =
= =
=![]() =8.2×108;
=8.2×108;
(2)已知c(MgCl2)=0.01mol/L,逐滴加入NaOH溶液,刚好出现沉淀时,c(Mg2+)=0.01mol/L,依据Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)可得c2(OH-)=1.8×10-11÷0.01=1.8×10-9,则c(OH-)=4.2×10-5mol/L,溶液中c(H+)= =2.4×10-10mol/L,此时溶液的pH=-lg2.4×10-10=9.6;当Mg2+完全沉淀时,c(Mg2+)=10-5mol/L所以c(OH-)=
=2.4×10-10mol/L,此时溶液的pH=-lg2.4×10-10=9.6;当Mg2+完全沉淀时,c(Mg2+)=10-5mol/L所以c(OH-)=![]() =1.3×10-3mol/L,则根据Kw=1.0×10-14可得c(H+)=10-14÷1.3×10-3=7.7×10-12mol/L,所以pH=11.1;
=1.3×10-3mol/L,则根据Kw=1.0×10-14可得c(H+)=10-14÷1.3×10-3=7.7×10-12mol/L,所以pH=11.1;
(3) Cu(OH)2+2H+![]() Cu2++2H2O的平衡常数K=
Cu2++2H2O的平衡常数K= =2.2×108。
=2.2×108。

 阅读快车系列答案
阅读快车系列答案【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%