题目内容
(1)将4molSO2和 2molO 2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
①用O2表示的反应的平均速率为
②平衡时SO2的转化率
③平衡时SO3的体积分数为
(2)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.
如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空
①温度的关系:T1 T2;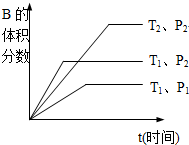
②压强的关系:P1 P2;
③化学计量数的关系:m+n q;(填“>”.“<”或“=”)
④该反应的逆反应为 反应.(填“吸热”或“放热”)
该反应的化学平衡常数的表达式K= .
(3)在FeCl3+3KSCN?Fe(SCN)3+3KCl的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 移动.
②在溶液中加入少量的KCl固体,平衡 移动.
①用O2表示的反应的平均速率为
②平衡时SO2的转化率
③平衡时SO3的体积分数为
(2)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.
如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空
①温度的关系:T1

②压强的关系:P1
③化学计量数的关系:m+n
④该反应的逆反应为
该反应的化学平衡常数的表达式K=
(3)在FeCl3+3KSCN?Fe(SCN)3+3KCl的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡
②在溶液中加入少量的KCl固体,平衡
考点:化学平衡的计算,化学平衡的影响因素,体积百分含量随温度、压强变化曲线
专题:
分析:(1)①v(SO3)=
=
=0.06mol/(L.s),根据同一反应中同一时间段内各物质的反应速率等于其计量数之比计算O2的反应的平均速率;
②达到平衡时,n(SO3)=0.6mol/L×2L=1.2mol,根据方程式知,参加反应的n(SO2)=n(SO3)=1.2mol,则平衡时SO2的转化率=
×100%;
③达到平衡时平衡时n(SO3)=1.2mol,n(SO2)=4mol-1.2mol=2.8mol,n(O2)=2mol-
×1.2mol=1.4mol,相同条件下,气体体积之比等于其物质的量之比,所以要计算SO3的体积分数只要计算三氧化硫的物质的量分数即可;
(2)①②根据图片中曲线“先拐先平数值大”确定温度、压强大小;
③增大压强,平衡向气体体积减小方向移动,根据B的体积分数变化确定计量数;
④升高温度,平衡向吸热反应方向移动,根据B的体积分数变化确定反应热;
化学平衡常数K为生成物气体浓度幂之积与反应物浓度幂之积的比;
(3)①在溶液中加入少量的KSCN固体,硫氰根离子浓度增大,平衡向着减小硫氰根离子的方向移动;
②该反应中钾离子和氯离子不参加反应,不影响平衡移动.
| △C |
| △t |
| 0.6mol/L |
| 10s |
②达到平衡时,n(SO3)=0.6mol/L×2L=1.2mol,根据方程式知,参加反应的n(SO2)=n(SO3)=1.2mol,则平衡时SO2的转化率=
| 1.2mol |
| 4mol |
③达到平衡时平衡时n(SO3)=1.2mol,n(SO2)=4mol-1.2mol=2.8mol,n(O2)=2mol-
| 1 |
| 2 |
(2)①②根据图片中曲线“先拐先平数值大”确定温度、压强大小;
③增大压强,平衡向气体体积减小方向移动,根据B的体积分数变化确定计量数;
④升高温度,平衡向吸热反应方向移动,根据B的体积分数变化确定反应热;
化学平衡常数K为生成物气体浓度幂之积与反应物浓度幂之积的比;
(3)①在溶液中加入少量的KSCN固体,硫氰根离子浓度增大,平衡向着减小硫氰根离子的方向移动;
②该反应中钾离子和氯离子不参加反应,不影响平衡移动.
解答:
解:(1)①v(SO3)=
=
=0.06mol/(L.s),同一反应中同一时间段内各物质的反应速率等于其计量数之比,所以v(O2)=
v(SO3)=
×0.06mol/(L.s)=0.03mol/(L.s),
故答案为:0.03mol/(L.s);
②达到平衡时,n(SO3)=0.6mol/L×2L=1.2mol,根据方程式知,参加反应的n(SO2)=n(SO3)=1.2mol,则平衡时SO2的转化率=
×100%=30%,
故答案为:30%;
③达到平衡时平衡时n(SO3)=1.2mol,n(SO2)=4mol-1.2mol=2.8mol,n(O2)=2mol-
×1.2mol=1.4mol,平衡时混合气体的物质的量=1.2mol+2.8mol+1.4mol=5.4mol,相同条件下,气体体积之比等于其物质的量之比,SO3的体积分数=
×100%=22.2%,
故答案为:22.2%;
(2)①相同压强时,根据“先拐先平数值大”知T1>T2,故答案为:>;
②相同温度时,根据图片中曲线“先拐先平数值大”知,P1<P2,故答案为:<;
③相同温度时,增大压强,平衡向气体体积减小方向移动,B的体积分数增大,说明平衡向逆反应方向移动,则正反应是气体体积增大的反应,所以m+n<q,故答案为:<;
④相同压强时,升高温度,平衡向吸热反应方向移动,B的体积分数减小,平衡向正反应方向移动,所以正反应是吸热反应,则逆反应是放热反应,化学平衡常数K=
,
故答案为:放热;
;
(3)①在溶液中加入少量的KSCN固体,硫氰根离子浓度增大,平衡向正反应方向移动,故答案为:正向;
②该反应中钾离子和氯离子不参加反应,不影响平衡移动,故答案为:不.
| △C |
| △t |
| 0.6mol/L |
| 10s |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:0.03mol/(L.s);
②达到平衡时,n(SO3)=0.6mol/L×2L=1.2mol,根据方程式知,参加反应的n(SO2)=n(SO3)=1.2mol,则平衡时SO2的转化率=
| 1.2mol |
| 4mol |
故答案为:30%;
③达到平衡时平衡时n(SO3)=1.2mol,n(SO2)=4mol-1.2mol=2.8mol,n(O2)=2mol-
| 1 |
| 2 |
| 1.2mol |
| 5.4mol |
故答案为:22.2%;
(2)①相同压强时,根据“先拐先平数值大”知T1>T2,故答案为:>;
②相同温度时,根据图片中曲线“先拐先平数值大”知,P1<P2,故答案为:<;
③相同温度时,增大压强,平衡向气体体积减小方向移动,B的体积分数增大,说明平衡向逆反应方向移动,则正反应是气体体积增大的反应,所以m+n<q,故答案为:<;
④相同压强时,升高温度,平衡向吸热反应方向移动,B的体积分数减小,平衡向正反应方向移动,所以正反应是吸热反应,则逆反应是放热反应,化学平衡常数K=
| cq(C) |
| cm(A).cn(B) |
故答案为:放热;
| cq(C) |
| cm(A).cn(B) |
(3)①在溶液中加入少量的KSCN固体,硫氰根离子浓度增大,平衡向正反应方向移动,故答案为:正向;
②该反应中钾离子和氯离子不参加反应,不影响平衡移动,故答案为:不.
点评:本题考查化学平衡计算、根据平衡影响元素判断反应热及气体计量数之和相对大小、平衡移动方向判断等知识点,侧重考查分析、计算、知识运用能力,会采用“定一议二”、“先拐先平数值大”分析图象,注意(3)②中KCl不影响平衡移动,为易错点.

练习册系列答案
相关题目
化学与生产、生活、社会密切相关,下列说法正确的是( )
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料 |