题目内容
下列电离方程式正确的是( )
| A、H2SO4═H2++SO42- |
| B、Ba(OH)2═Ba2++2OH- |
| C、NaNO3═Na++N5++O32- |
| D、K2CO3═K++CO3-2 |
考点:电离方程式的书写
专题:
分析:强电解质完全电离,用等号;弱电解质部分电离用可逆号,原子团不能拆,据此判断.
解答:
解:A.H2SO4是强电解质完全电离,电离方程式为:H2SO4═2H++SO42-,故A错误;
B.Ba(OH)2是强电解质完全电离,电离方程式为:Ba(OH)2═Ba2++2OH-,故B正确;
C.硝酸根是原子团不能拆,电离方程式为:NaNO3═Na++NO3-,故C错误;
D.K2CO3是强电解质完全电离,电离方程式为:K2CO3═K++CO32-,故D错误;
故选:B.
B.Ba(OH)2是强电解质完全电离,电离方程式为:Ba(OH)2═Ba2++2OH-,故B正确;
C.硝酸根是原子团不能拆,电离方程式为:NaNO3═Na++NO3-,故C错误;
D.K2CO3是强电解质完全电离,电离方程式为:K2CO3═K++CO32-,故D错误;
故选:B.
点评:本题考查了电离方程式的书写,准确判断电解质的强弱是解题关键,注意原子团不能拆,题目难度不大.

练习册系列答案
相关题目
以下说法正确的是( )
| A、物质所含元素化合价升高的反应叫还原反应 |
| B、氢氧化铁胶体带正电,通电后向阴极运动 |
| C、胶体与其他分散系的本质区别是丁达尔效应 |
| D、还原剂中必定有元素化合价升高被氧化 |
25℃将相同物质的量浓度的CH3COOH和NaOH溶液混合,欲使混合液的pH=7,则CH3COOH溶液的体积V1和NaOH溶液的体积V2的关系是( )
| A、V1=V2 |
| B、V1>V2 |
| C、V1<V2 |
| D、V1≥V2 |
下列有关化学用语表达正确的是( )
A、次氯酸的电子式: |
B、CCl4分子的球棍模型: |
| C、乙醛结构简式:CH3CHO |
D、H2O2的电子式: |
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A、标准状况下,22.4 L O2含有的分子数为NA |
| B、常温常压下,3.4 g H2O2含有极性键的数目为0.2 NA |
| C、将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol?L-1 |
| D、标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA |
SiO2是水晶的主要成分,SiO2属于( )
| A、酸 | B、碱 | C、盐 | D、氧化物 |
元素周期表中铋元素的数据见图,下列说法正确的是( )


| A、Bi元素的质量数是209.0 |
| B、Bi元素中子数为83 |
| C、Bi原子6p亚层有有一个未成对电子 |
| D、Bi位于第六周期VA族,属于p区 |
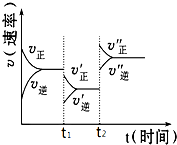 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A、t1时,减小了A或B的物质的量的浓度 |
| B、t2时,升高了温度 |
| C、t2时,增大了压强 |
| D、t1时,加了催化剂 |