题目内容
0.5L1mol/LFeCl3溶液与0.2L1mol/LKCl溶液中的Cl-的数目之比
A.5:2 B.3:1 C.15:2 D.1:3
练习册系列答案
相关题目
2.已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-57.3kJ•mol-1,则HCN在水溶液中电离的△H等于( )
| A. | +45.2 kJ•mol-1 | B. | -45.2 kJ•mol-1 | C. | -69.4 kJ•mol-1 | D. | +69.4 kJ•mol-1 |
3.为了探究化学反应中的能量变化,某同学设计了如下两个实验.
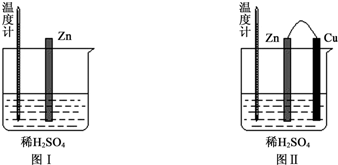
(1)图Ⅰ中发生反应的化学方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度变化及其原因是升高;锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如表,请完成相应实验现象的解释.
(3)若将图中的Cu片替换为Fe片,则Fe片上的电极反应式为2H++2e-=H2↑.

(1)图Ⅰ中发生反应的化学方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度变化及其原因是升高;锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如表,请完成相应实验现象的解释.
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |


 .
.