题目内容
下列混合气体, 经点燃反应后得到纯净物的是
[ ]
A.质量比为4:7的氧气和一氧化碳 B.体积比为5:2的空气和氢气
C.物质的量之比为2:1的氢气和氧气 D.分子个数比为1:2的甲烷和氧气
答案:AC
解析:
解析:
|
A:2CO+O2=2CO2 2CO──O2 56 32 7 4 只得到CO2 B:空气5V中含O21V,N24V
O2 + 2H2 = 2H2O 1 2 除生成水外还有氮气 C:2H2 + O2 = 2H2O 2 1 只有水 D:CH4+2O2=CO2+2H2O 有水和二氧化碳两种物质 |

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
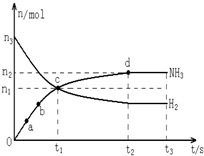 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题: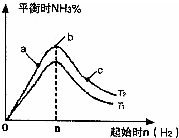 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: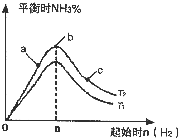 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: