题目内容
5. 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O(1)X基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1.
(2)C、H、O三种原子的电负性由大到小的顺序为O>C>H.
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图所示:
①与CO为互为等电子体的阴离子和阳离子分别是CN-或C22-,NO+
②该配合物中氯原子的杂化方式为sp3.
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键
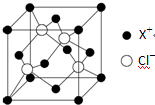
(4)如图所示一晶胞,距离每个X+最近的Cl-的个数为4.在1个晶胞中,X离子的数目为4.该化合物的化学式为CuCl.
分析 (1)根据题目给出信息判断出X为铜元素,结合构造原理写出核外电子排布式;
(2)元素非金属性越强,电负越强;
(3)①等电子体为原子数和价电子数分别相同的离子或原子团;
②根据氯原子形成的共价键和孤对电子数目判断;
③表示配位键时,箭头指向提供空轨道的原子或离子;
(4)根据晶胞结构和均摊法判断离子数目以及化学式.
解答 解:(1)由于含有7个能级,根据能量最低原则,写出7个能级为1s2s2p3s3p3d4s;且最外层电子数为1,X原子的内层轨道全部排满电子,电子排布为1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)元素非金属性越强,电负越强,则C、H、O的电负性由大到小的顺序是:O>C>H,
故答案为:O>C>H;
(3)①CO分子中含有2个原子、价电子数是10,与CO互为等电子体的阴离子微粒有CN-或C22-,阳离子为NO+,
故答案为:CN-或C22-;NO+;
②氯原子与X原子形成了1条配位键,1条共价键,另外存在2对孤对电子,即有4个杂化轨道,杂化类型为sp3,
故答案为:sp3;
③根据氯原子最外层电子数为7可知,氯原子可形成一对共用电子对,即氯原子形成的两条共价键中只有一条为配位键,而X可形成三条配位键,可据此标出配位键,
故答案为: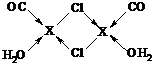 ;
;
(4)每个晶胞顶点的X+最近的Cl-有1个,在晶胞的体内,4个晶胞共用这个顶点,则X+最近的Cl-的个数为4个;每个晶胞中X+位于顶点和面上,则个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个晶胞中Cl-的在体内,个数为4个,则化学式为CuCl,故答案为:4;4;CuCl.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性大小比较、杂化方式与等电子体,注意对基础知识的理解掌握,题目难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 能使湿润的酚酞试液变红 | |
| B. | 能使湿润的红色石蕊试纸变蓝 | |
| C. | 氨气的水溶液呈中性 | |
| D. | 气体与蘸有浓盐酸的玻璃棒靠近产生大量白烟 |
| A. | 1:1 | B. | 2:3 | C. | 3:1 | D. | 1:6 |
| A. | v(D)=1mol/(L•s) | B. | v(B)=1mol/(L•min) | C. | v(A)=0.5mol/(L•s) | D. | v(C)=0.8mol/(L•s) |
| A. | 向苦卤(含K+、Mg2+、Br-等)中通入Cl2是为了提取溴 | |
| B. | 粗盐(含Ca2+、Mg2+、SO42-、泥沙等杂质)可采用除杂和重结晶等过程提纯 | |
| C. | 海带提碘只涉及物理变化,海水提镁涉及复分解反应 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
| A. | 1 mol NH3 分子 | B. | NH3和NH4+ 总共1 mol | ||
| C. | NH3•H2O 1 mol | D. | NH3•H2O、NH3、NH4+ 总共1 mol |
| A. | O2与O5 | |
| B. | 1H和2H | |
| C. | 淀粉和纤维素 | |
| D. | CH3-CH2-CH2-CH3与 CH3-CH (CH3)-CH3 |
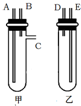 某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作.步骤如下:
某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作.步骤如下: