题目内容
在一定条件下,NO能跟H2发生如下反应:2NO+2H2═N2+2H2O.经研究,上述反应是按以下三步反应依次进行的总反应(括号中是该条件下反应的相对速率):(Ⅰ)2NO+H2═N2O+H2O(慢);(Ⅱ)2N2O═2N2+O2(快);(Ⅲ)2H2+O2═2H2O(更快).以上总反应的速率主要取决于三步反应中的( )
| A、(Ⅰ) | B、(Ⅱ) |
| C、(Ⅲ) | D、(Ⅱ)和(Ⅲ) |
考点:化学反应速率的调控作用
专题:化学反应速率专题
分析:若总包反应由一系列快慢悬殊的连续步骤组成,总反应速率就决定于其中最慢的一步,即控制步骤.
解答:
解:若总反应由一系列快慢悬殊的连续步骤组成,总反应速率就决定于其中最慢的一步,(Ⅰ)2NO+H2═N2O+H2O反应速率最慢,所以总反应的速率主要取决于三步反应中的(Ⅰ).
故选:A.
故选:A.
点评:若总反应由一系列快慢悬殊的连续步骤组成,总反应速率就决定于其中最慢的一步,扩散控制是由于化学反应太快,扩散来不及供给反应以足够的分子所致..

练习册系列答案
相关题目
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( )
A、 制取氯气 |
B、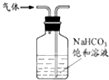 除去氯气中的少量氯化氢 |
C、 分离二氧化锰和氯化锰溶液 |
D、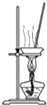 蒸干氯化锰溶液制MnCl2?4H2O |
在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2?2SO3,下列叙述能够说明反应已经达到平衡状态的是( )
| A、反应容器中压强不随时间变化 |
| B、容器中SO2、O2、SO3的物质的量之比为2:1:2 |
| C、SO2与SO3的浓度相等 |
| D、容器中SO2、O2、SO3共存 |
研究表明,化学反应中的能量变化其本质是化学键的生成或断裂过程中分别会释放与吸收能量.如图表示反应2H2(g)+O2(g)═2H2O(g)的能量变化,下列有关说法中错误的是( )


| A、图中的①是指吸收能量,②是指放出能量 |
| B、图示说明反应2H2(g)+O2(g)═2H2O(g)是一个吸热反应 |
| C、图示说明化学键的形成与断裂是物质在化学反应中发生能量变化的主要原因 |
| D、③中a所指的数值为484 |
下列说法正确的是( )
| A、放热反应发生时不必加热,吸热反应在加热后才能发生 |
| B、反应热指的是反应过程中放出的热量 |
| C、反应热的大小与反应的途径有关,无论是一步完成还是分几步完成,其反应热基本相同 |
| D、依据盖斯定律,热化学方程式具有加合性,也可以进行加、减、乘、除四则运算 |
下列溶液中物质的量浓度肯定为1mol/L的是( )
| A、将40gNaOH固体溶解于1L水中 |
| B、将22.4L氯化氢气体溶于水配成1L溶液 |
| C、4gNaOH固体溶解在水中配成100mL溶液 |
| D、将1L10mol/L浓盐酸与10L水混合 |



