题目内容
14.下列有关说法正确的是CE.A.电离、电解、电镀、电化学腐蚀都需要通电后才能实现
B.可用pH试纸测定新制氯水的pH
C.水是一种极弱的电解质,纯水在任何情况下都显中性
D.空气中,金属铝的表面会迅速形成一层致密的氧化物保护膜,这是铝发生了吸氧腐蚀
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)>Ksp(CuS)
F.在配制硫酸铁溶液时,为了防止发生水解,可以加入少量的稀盐酸.
分析 A、电解、电泳、电镀需要通电才可进行,条件是通电,而电离、原电池导致的腐蚀不需要通电;
B、新制的氯水中含有次氯酸,能够漂白pH试纸,无法测定出氯水的pH;
C、水是一种极弱的电解质,纯水在任何情况下都显中性
D、铝非常活泼,易被空气中的氧气氧化,生成氧化膜,是化学腐蚀;
E、根据白色沉淀ZnS转化成CuS黑色沉淀,说明CuS溶解度小于ZnS,同类型的沉淀,溶解度越小,Ksp越小;
F、在配制硫酸铁溶液时,为了防止发生水解,加相应的酸.
解答 解:A、电解、电泳、电镀需要通电才可进行,条件是通电,而电离、原电池导致的腐蚀不需要通电,故错误;
B、新制的氯水中存在次氯酸,次氯酸具有强氧化性,能够漂白有色物质,所以无法用pH试纸测定新制氯水的pH,故错误;
C、水是一种极弱的电解质,纯水在任何情况下都显中性,电离产生的氢离子和氢氧根离子的量相等,故正确;
D、铝非常活泼,易被空气中的氧气氧化,生成氧化膜,是化学腐蚀,故错误;
E、根据白色沉淀ZnS转化成CuS黑色沉淀,说明CuS溶解度小于ZnS,同类型的沉淀,溶解度越小,Ksp越小,说明Ksp(ZnS)>Ksp(CuS),故正确;
F、在配制硫酸铁溶液时,为了防止发生水解,加硫酸,故错误;故答案为:CE.
点评 本题主要考查的是综合题目,其中E沉淀转化的实质,沉淀现象是分析判断的依据,题目较简单.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
4.设阿伏加德罗常数的数值为nA,下列说法正确的是( )
| A. | 1molCl2溶于水反应,反应转移电子数为nA | |
| B. | 56g晶体硅中含有硅分子数为2nA | |
| C. | 1 mol Cu和足量稀硝酸反应产生nA个NO分子 | |
| D. | 标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2nA |
5.下列过程有热量放出的是( )
| A. | 醋酸的电离 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |
2.有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为( )
| A. | 2:1 | B. | 1:1 | C. | 1:2 | D. | 4:2 |
9.下列各物质的中心原子采用sp3杂化的是( )
| A. | NH3 | B. | O3 | C. | CO2 | D. | BeCl2 |
19.环境问题越来越受到人们的关注,下列有关叙述不正确的是( )
| A. | 空气质量监测中的PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称可入肺颗粒物 | |
| B. | 采用纳米TiO2光触媒技术,将汽车尾气中的NO和CO转化为无害气体 | |
| C. | 大量排放SO2或CO2都会导致酸雨的形成 | |
| D. | 利用太阳能、潮汐能、风力发电,以获取清洁能源减少污染 |
6.某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
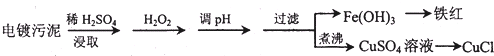
(1)酸浸后加入H2O2的目的是将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离.调pH步骤中加入的试剂最好是CuO、或Cu(OH)2、或CuCO3(填化学式).实验室进行过滤操作所用到的玻璃仪器有漏斗、烧杯、玻璃棒.
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品符合(填“符合”或“不符合”)国家标准.
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为2.5×10-5.

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品符合(填“符合”或“不符合”)国家标准.
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为2.5×10-5.
3.已知 HF 酸性比 HCN 的酸性强.现有物质的量浓度和体积均相同的 NaF 和 NaCN 两种溶液,已知前者溶液中的离子数目为 n1,后者溶液中离子数目为 n2,下列关系正确的是( )
| A. | n1>n2 | B. | n1=n2 | C. | n2>n1 | D. | c(F-)<c(CN-) |
4.下列物质属于脂肪烃的是( )
| A. |  | B. |  | C. |  | D. |  |