题目内容
某研究性学习小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产提取镁,主要过程如下图1:

回答下列问题:
(1)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 饱和溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2.写出有关反应的离子方程式 .
(2)如2图是该研究性学习小组设计进行过程③的实验装置图.其中左侧装置的作用是 .若要验证所得无水MgCl2中不含NaCl,最简单的操作是 .
(3)写出过程④中发生反应的化学方程式 .

回答下列问题:
(1)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有
(2)如2图是该研究性学习小组设计进行过程③的实验装置图.其中左侧装置的作用是
(3)写出过程④中发生反应的化学方程式
考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:贝壳煅烧得到生石灰,生石灰加水得到石灰乳,在海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中加入石灰乳,MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,过滤得到氢氧化镁沉淀;从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,Ca(OH)2能与饱和MgCl2溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀,加入盐酸,氢氧化镁与盐酸反应Mg(OH2)+2HCl=MgCl2+2H2O,过程②降温结晶得到MgCl2?6H2O,氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,所以过程③在氯化氢气流中干燥产物得到无水氯化镁,过程④电解无水氯化镁得到镁.
(1)氢氧化钙微溶,氢氧化镁难溶,根据沉淀转化除杂原理选择试剂;根据分离不溶于水的固体的方法是过滤进行;
(2)浓硫酸稀释放热,氯化氢具有挥发性,浓盐酸滴加到浓硫酸中有氯化氢气体产生,氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,检验钾、钠离子用焰色反应;
(3)根据电解无水氯化镁得到镁和氯气分析;
(1)氢氧化钙微溶,氢氧化镁难溶,根据沉淀转化除杂原理选择试剂;根据分离不溶于水的固体的方法是过滤进行;
(2)浓硫酸稀释放热,氯化氢具有挥发性,浓盐酸滴加到浓硫酸中有氯化氢气体产生,氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,检验钾、钠离子用焰色反应;
(3)根据电解无水氯化镁得到镁和氯气分析;
解答:
解:贝壳煅烧得到生石灰,生石灰加水得到石灰乳,在海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中加入石灰乳,MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,过滤得到氢氧化镁沉淀;从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,Ca(OH)2能与饱和MgCl2溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀,加入盐酸,氢氧化镁与盐酸反应Mg(OH2)+2HCl=MgCl2+2H2O,过程②降温结晶得到MgCl2?6H2O,氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,所以过程③在氯化氢气流中干燥产物得到无水氯化镁,过程④电解无水氯化镁得到镁.
(1)氢氧化钙微溶,氢氧化镁难溶,Ca(OH)2能与饱和MgCl2溶液反应Ca(OH)2+Mg2+=Mg(OH2)+Ca2+,
生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀,在此过程中玻璃棒的作用是搅拌和引流,
故答案为:饱和MgCl2溶液;过滤、洗涤;Ca(OH)2+Mg2+=Mg(OH2)+Ca2+;
(2)过程③在氯化氢气流中干燥产物得到无水氯化镁,浓硫酸稀释放热,氯化氢具有挥发性,所以图2中浓盐酸滴加到浓硫酸中有氯化氢气体产生,氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,所以其中装置A的作用是制备干燥的HCl气体,抑制MgCl2的水解,若要验证所得无水MgCl2中不含NaCl,最简单的操作是:用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠,
故答案为:制备干燥的HCl气体,抑制MgCl2的水解;用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠;
(3)电解无水氯化镁得到镁和氯气,方程式为:MgCl2
Mg+Cl2↑,
故答案为:MgCl2
Mg+Cl2↑;
(1)氢氧化钙微溶,氢氧化镁难溶,Ca(OH)2能与饱和MgCl2溶液反应Ca(OH)2+Mg2+=Mg(OH2)+Ca2+,
生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀,在此过程中玻璃棒的作用是搅拌和引流,
故答案为:饱和MgCl2溶液;过滤、洗涤;Ca(OH)2+Mg2+=Mg(OH2)+Ca2+;
(2)过程③在氯化氢气流中干燥产物得到无水氯化镁,浓硫酸稀释放热,氯化氢具有挥发性,所以图2中浓盐酸滴加到浓硫酸中有氯化氢气体产生,氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,所以其中装置A的作用是制备干燥的HCl气体,抑制MgCl2的水解,若要验证所得无水MgCl2中不含NaCl,最简单的操作是:用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠,
故答案为:制备干燥的HCl气体,抑制MgCl2的水解;用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠;
(3)电解无水氯化镁得到镁和氯气,方程式为:MgCl2
| ||
故答案为:MgCl2
| ||
点评:本题主要考查了工业生产来提取镁的流程,侧重考查混合物分离提纯,把握流程中的分离方法为解答的关键,注意氯化镁的性质和制镁的方法,题目难度中等.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
X、Y、Z是分别位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z属于同一主族,三种元素可以形成原子个数比为1:1:1的化合物W.下列推测正确的是( )
| A、元素Z的氧化物一定属于碱性氧化物 |
| B、原子半径关系是:X<Y<Z |
| C、三种元素中,Y的金属性最强 |
| D、Y、Z都能形成含氧酸,且前者的酸性比后者酸性强 |
下列说法正确的是( )
| A、离子化合物中一定含有离子键 |
| B、含有共价键的化合物一定是共价化合物 |
| C、强电解质与弱电解质的划分标准是电解质在水溶液中导电能力的强弱 |
| D、氧气中氧元素的化合价为0,所以氧分子中没有化学键 |
下列物质的分类合理的是( )
| A、酸性氧化物:Na2O、CaO、CuO |
| B、碱:烧碱、纯碱、苛性钾 |
| C、盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、氧化物:CO2、NO、SO2、H2O |
如图是高中化学教科书中元素周期表的一部分,下列说法中正确的是( )
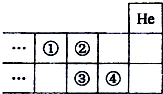

| A、①的气态氢化物比②的稳定 |
| B、②的最高价含氧酸的酸性比③强 |
| C、③的非金属性比④强 |
| D、④的原子半径比③小 |
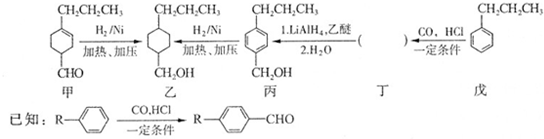
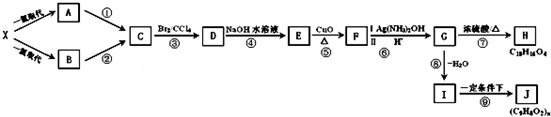
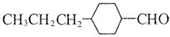 和
和 ]
]

 ②含有对位二取代苯环
②含有对位二取代苯环 是合成某些药物的中间体.试设计合理方案由化合物
是合成某些药物的中间体.试设计合理方案由化合物 合成
合成 .
. 在400℃有金属氧化物存在条件下能发生脱羰基(
在400℃有金属氧化物存在条件下能发生脱羰基( )反应.
)反应.