题目内容
12.以溴乙烷为原料制取1,2二溴乙烷,下列转化方案中最合理的是( )| A. | CH3CH2Br$→_{△}^{HBr溶液}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{△}^{NaOH的乙醇溶液}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$→_{△}^{NaOH的乙醇溶液}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
分析 溴乙烷含有溴原子,可在氢氧化钠水溶液中发生水解反应,在氢氧化钠醇溶液中发生消去反应,应先发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,要考虑到反应原理是否正确外,还要考虑到对环境是否造成污染,以及生产成本问题,以此解答该题.
解答 解:A.溴乙烷在溴化氢溶液、加热条件下,不能反应生成1,2二溴乙烷,原理错误,故A错误;
B.不能保证CH3CH2Br和Br2发生取代反应时只生成1,2二溴乙烷,生成物太复杂,不易分离,故B错误;
C.不能保证CH2BrCH3和Br2发生取代反应时只生成1,2二溴乙烷,生成物太复杂,不易分离,故C错误;
D.溴乙烷在氢氧化钠醇溶液、加热条件下发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2二溴乙烷,原理正确,不存在其它副产物,故D正确,
故选D.
点评 本题考查有机物的合成,为高频考点,把握官能团的变化、有机反应为解答的关键,侧重分析与应用能力的考查,注意取代反应、加成反应的特点及合成方案的评价,题目难度不大.

练习册系列答案
相关题目
5.Q、W、X、Y、Z是原子序数依次增大的短周期元素,Q和Y均满足主族序数与周期序数相等,Q与X、W与Z同主族,Q和W能形成原子个数之比为1:1和2:1的常见无机化合物.下列说法不正确的是( )
| A. | 简单离子半径:Z>W>X>Y | |
| B. | W、X形成的化合物中一定含有离子键 | |
| C. | 最简单氢化物的还原性:Z>W | |
| D. | 工业上常用电解熔融氯化物的方法制备X、Y的单质 |
20.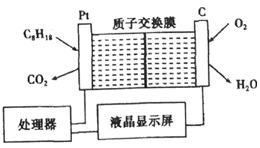 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式为:C8H18+16H2O-50e-═8CO2+50H+ | |
| C. | 每消耗标准状况下5.6 L O2溶液中通过lmol 电子 | |
| D. | H+由质子交换膜左侧向右侧迁移 |
17.中学化学常见物质A、B、C、D、X、Y,存在如图转化关系(部分物质和条件略去)请根据要求回答下列问题:

(1)若A为NaOH溶液,X为CO2,D是沉淀,①则Y可为BD(填序号).
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
②A可与C反应生成B的离子方程式为HCO3-+OH-=CO32-+H2O.
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,A与D反应生成一种化肥,
①实验室制备气体A的反应、收集和尾气处理装置如图依次为ACG.用此装置制备A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.

②写出木炭与D的浓溶液在加热的条件下发生反应的化学方程式4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑.
(3)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,
①检验B溶液中是否存在C的试剂可选用C(填序号).
A.Cl2 B.NaOH溶液 C.酸性KMnO4 D.KSCN溶液
②C溶液在贮存时应加入少量X,其理由是(用离子方程式说明)2Fe3++Fe=3Fe2+.
(4)若A金属,D为强碱,则:
①写出A与水反应生成D的离子方程式2Na+2H2O=2Na++2OH-+2H2↑.
②反应Ⅲ中,还原剂是Na2O2.
(5)若A为淡黄色固体单质,D是强酸,
①把一定量的锌与100mL 18.5mol•L-1的D充分反应后,锌完全溶解,同时生成气体M 33.6L(标准状况).将反应后的溶液稀释到1L后溶液的c(H+)=0.1mol•L-1,则下列叙述不正确的是B.
②为了分离气体M,并分别得到干燥的气体,某学生设计了如图实验装置,a、b为活塞,且每个装置中的溶液均过量.甲容器中盛C;乙容器中盛A(填字母).
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液

气体M实验时,关闭b,打开a,此时分离出的气体是H2;当分离完一种气体后,关闭a,打开b,此时得到的气体是SO2.

(1)若A为NaOH溶液,X为CO2,D是沉淀,①则Y可为BD(填序号).
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
②A可与C反应生成B的离子方程式为HCO3-+OH-=CO32-+H2O.
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,A与D反应生成一种化肥,
①实验室制备气体A的反应、收集和尾气处理装置如图依次为ACG.用此装置制备A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.

②写出木炭与D的浓溶液在加热的条件下发生反应的化学方程式4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑.
(3)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,
①检验B溶液中是否存在C的试剂可选用C(填序号).
A.Cl2 B.NaOH溶液 C.酸性KMnO4 D.KSCN溶液
②C溶液在贮存时应加入少量X,其理由是(用离子方程式说明)2Fe3++Fe=3Fe2+.
(4)若A金属,D为强碱,则:
①写出A与水反应生成D的离子方程式2Na+2H2O=2Na++2OH-+2H2↑.
②反应Ⅲ中,还原剂是Na2O2.
(5)若A为淡黄色固体单质,D是强酸,
①把一定量的锌与100mL 18.5mol•L-1的D充分反应后,锌完全溶解,同时生成气体M 33.6L(标准状况).将反应后的溶液稀释到1L后溶液的c(H+)=0.1mol•L-1,则下列叙述不正确的是B.
| A.气体M是SO2和H2的混合物 | B.气体M是SO2和H2的体积比为4:1 |
| C.反应中共消耗锌97.5g | D.反应中共转移电子3mol |
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液

气体M实验时,关闭b,打开a,此时分离出的气体是H2;当分离完一种气体后,关闭a,打开b,此时得到的气体是SO2.
7.用NaOH溶液吸收尾气中的SO2,将所得的Na2SO3溶液进行电解再生循环脱硫,其原理如图,a、b离子交换膜将电解槽分成为三个区域,电极材料均为石墨.甲~戊分别代表生产中的原料或产品,其中丙为硫酸溶液.下列说法错误的是( )

| A. | 图中a表示阳离子交换膜 | |
| B. | 当电路中通过1mol电子的电量时,会有0.25mol的O2生成 | |
| C. | 甲为NaOH溶液 | |
| D. | 阳极的电极反应式为SO32-+H2O-2e-=SO42-+2H+ |
1.H 是一种性能优异的高分子材料,其结构简式为 ,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )
,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )
①加成反应②取代反应③缩聚反应④加聚反应⑤酯化反应.
 ,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )
,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )①加成反应②取代反应③缩聚反应④加聚反应⑤酯化反应.
| A. | ①④⑤ | B. | ①④ | C. | ①②④ | D. | ①②③ |
2.在2L密闭容器中,发生3A(g)+B(g)?2C(g)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol•Lˉ1•sˉ1,则10秒钟后B的物质的量为( )
| A. | 2.8mol | B. | 1.6mol | C. | 3.2mol | D. | 3.6mol |
