题目内容
【题目】实验室制取乙酸乙酯的主要步骤如下:
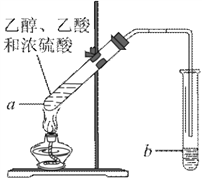
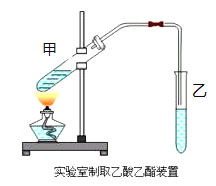
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按下图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1)写出制取乙酸乙酯的化学方程式:___________________________________。
(2)在反应未开始前,乙试管中所盛溶液为____________________。
【答案】 CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O 饱和Na2CO3溶液
CH3COOCH2CH3 + H2O 饱和Na2CO3溶液
【解析】(1)实验室制取乙酸乙酯的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。(2)由于生成的乙酸乙酯中含有乙醇和乙酸,需要利用饱和碳酸钠溶液除去,即在反应未开始前,乙试管中所盛溶液为饱和碳酸钠溶液。
CH3COOCH2CH3+H2O。(2)由于生成的乙酸乙酯中含有乙醇和乙酸,需要利用饱和碳酸钠溶液除去,即在反应未开始前,乙试管中所盛溶液为饱和碳酸钠溶液。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。

容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是
A. 由图可知T1<T2,且该反应为吸热反应
B. 前10min内甲、乙、丙三个容器中反应的平均速率:v(A)乙<v(A)甲< v(A)丙
C. 平衡时A的转化率a:a乙<a甲<a丙
D. T1时该反应的平衡常数K=7.2