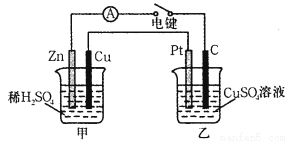
题目内容
下列情况会对人体健康造成较大危害的是
A.自来水中通入少量Cl2进行消毒杀菌
B.用SO2漂白食品
C.用食醋清洗热水瓶胆内壁附着的水垢
D.用小苏打发酵面团制作馒头
B
【解析】
试题分析:A.氯气通入水中生成次氯酸,次氯酸有强氧化性能够杀死水中的细菌,正确;B.SO2漂白原理是和有色物质化合生成无色物质,该无色物质受热或在体内会分解生成有刺激性气味且有毒的气体二氧化硫,错误;C.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)发生反应生成易溶于水的醋酸钙从而洗净瓶胆,正确;D.用小苏打发酵面团制作馒头,正确。
考点:考查生活中的化学知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(10分)Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
①S2O32-能被I2氧化为无色的S4O62-;
②酸性条件下S2O32-迅速分解为S和SO2
I.市售Na2S2O3中常含有SO42-,请完成以下方案,检验其中含有的SO42-:
实验步骤 | 预期现象或结论 |
步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
步骤2:加入过量盐酸 | |
步骤3: | 有白色沉淀产生,说明样品中含有SO42- |
Ⅱ.利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
①溶液配制:称取1.000g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL 0.01000mol·L-1 K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③往步骤②所得溶液加入淀粉作指示剂,用Na2S2O3滴定至终点(2S2O32-+ I2 === S4O62-+ 2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2)完成并配平步骤②中的离子反应:
Cr2O72- + ( ) + I- === I2 + Cr3+ + H2O
(3)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 (保留两位有效数字)。


 B.
B.
 D.
D.