题目内容
(一)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:
2CO(g)+O2(g)═2CO2(g);△H=566kJg?moL-1
2H2(g)+O2(g)═2H2O(g)△H=483.6kJ g?moL-1
H2O(g)═H2O(I);△H=44.0kJg?moL-1
(1)氢气的燃烧热为 kJg?moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式 .
(二)在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)?CO(g)+H2O(g) 其平衡常数K和温度t的关系如下:
(1)K的表达式为: ;
(2)该反应的正反应为 反应(“吸热”或“放热”)
(3)能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
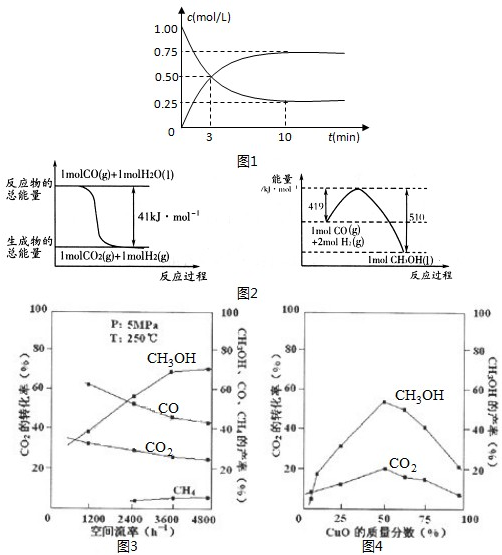
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
计算:3min-4min达到平衡时CO的平衡浓度c3和CO2(g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)
2CO(g)+O2(g)═2CO2(g);△H=566kJg?moL-1
2H2(g)+O2(g)═2H2O(g)△H=483.6kJ g?moL-1
H2O(g)═H2O(I);△H=44.0kJg?moL-1
(1)氢气的燃烧热为
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(二)在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)?CO(g)+H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2)该反应的正反应为
(3)能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
考点:热化学方程式,化学平衡状态的判断,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(一)(1)由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、H2O(g)═H2O(l)△H=-44.0KJ/mol来计算;
(2)利用2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol结合盖斯定律来写出CO和 H2O(g)作用生成CO2和H2的热化学方程式;
(二)(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)平衡常数与温度的关系判断平衡移动方向进行分析判断吸热放热;
(3)根据化学平衡状态的特征-正逆反应速率相等,各组分含量保持不变进行判断;
(4)依据容器中浓度变化结合化学平衡的三段式列式计算,结合平衡常数不随温度变化,根据转化率公式进行计算.
(2)利用2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol结合盖斯定律来写出CO和 H2O(g)作用生成CO2和H2的热化学方程式;
(二)(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)平衡常数与温度的关系判断平衡移动方向进行分析判断吸热放热;
(3)根据化学平衡状态的特征-正逆反应速率相等,各组分含量保持不变进行判断;
(4)依据容器中浓度变化结合化学平衡的三段式列式计算,结合平衡常数不随温度变化,根据转化率公式进行计算.
解答:
解:(一)(1)由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、2H2O(g)═2H2O(l)△H=-88.0KJ/mol,即2mol氢气燃烧生成液态水,放出的热量为483.6kJ+88kJ=571.6kJ,
则1mol氢气燃烧生成液态水时放出的热量为285.8kJ,
故答案为:285.8;
(2)由①2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,
根据盖斯定律可知
得CO(g)+H2O(g)═CO2(g)+H2(g),△H=
=-41.2kJ/mol,
即热化学反应方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol,
故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol;
(二)(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
,
故答案为:
;
(2)温度越高,K值越小,说明升温平衡向逆反应方向移动,故正反应为放热反应,
故答案为:放热;
(3)A.因该反应为反应前后气体体积不变的反应,故容器中压强不变不能作为平衡状态的判据,故A错误;
B.混合气体中CO浓度不变,表明各组分的浓度不再变化,达到了平衡状态,故B正确;
C.v(H2)正=v(H2O)逆,说明正逆反应速率相等,能作为平衡状态的判据,故C正确;
D.c(CO2)=c(CO)不能判断化学平衡状态,和起始量有关,故D错误;
故答案为:BC;
(4)
CO2(g)+H2(g)?CO(g)+H2O(g)
起始浓度/mol?L-1 0.2 0.3 0 0
变化浓度/mol?L-1:c3 c3 c3 c3
平衡浓度/mol?L-1:0.2-c3 0.3-c3 c3 c3
由题意知,850℃时,K=1.0,即
K=
=
=1.0,
解得 c3=0.12mol/L,
二氧化碳的转化率=
×100%=60%,
故答案为:0.12mol/L;60%.
则1mol氢气燃烧生成液态水时放出的热量为285.8kJ,
故答案为:285.8;
(2)由①2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,
根据盖斯定律可知
| ①-② |
| 2 |
| -566kJ/mol-(-483.6kJ/mol) |
| 2 |
即热化学反应方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol,
故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol;
(二)(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
故答案为:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)温度越高,K值越小,说明升温平衡向逆反应方向移动,故正反应为放热反应,
故答案为:放热;
(3)A.因该反应为反应前后气体体积不变的反应,故容器中压强不变不能作为平衡状态的判据,故A错误;
B.混合气体中CO浓度不变,表明各组分的浓度不再变化,达到了平衡状态,故B正确;
C.v(H2)正=v(H2O)逆,说明正逆反应速率相等,能作为平衡状态的判据,故C正确;
D.c(CO2)=c(CO)不能判断化学平衡状态,和起始量有关,故D错误;
故答案为:BC;
(4)
CO2(g)+H2(g)?CO(g)+H2O(g)
起始浓度/mol?L-1 0.2 0.3 0 0
变化浓度/mol?L-1:c3 c3 c3 c3
平衡浓度/mol?L-1:0.2-c3 0.3-c3 c3 c3
由题意知,850℃时,K=1.0,即
K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c32 |
| (0.2-c3)(0.3-c3) |
解得 c3=0.12mol/L,
二氧化碳的转化率=
| 0.12mol/L |
| 0.2mol/L |
故答案为:0.12mol/L;60%.
点评:本题主要考查热化学方程式、温度对化学平衡、化学平衡常数的影响,化学平衡常数的计算,化学平衡的标志判断,难度不大,考查学生分析和解决问题的能力.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列实验基本操作(或实验注意事项)中,主要是从实验安全角度考虑的是( )
| A、实验剩余的药品一般不能放回原试剂瓶 |
| B、溶解时用玻璃棒搅拌 |
| C、可燃性气体点燃前必须验纯 |
| D、过滤时玻璃棒靠在三层滤纸处 |
下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
| A、Na+ Ba2+ Cl- SO42- |
| B、K+ AlO2- NO3- OH- |
| C、H+ NH4+ Al3+ SO42- |
| D、H+ Cl- CH3COO- NO3- |