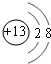
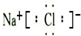题目内容
同主族元素在原子结构上有什么相似的地方?又有什么递变?这决定着元素的性质有什么相似之处和递变规律?
解析:
|
“同主族元素”这一位置关系,决定了这些元素的最外层上的电子数是相同的,因此它们的最高正价和最低负价都分别相同,它们的同类化合物的结构相似,性质也相似.但同主族内,随着原子序数的递增,电子层数逐渐增多,原子半径逐渐增大,核对外层电子的吸引力逐渐减小,因此,得电子的能力逐渐减弱,失电子的能力逐渐增强. |
提示:
|
元素周期表与元素原子结构特点和元素的性质有着密切的关系,元素在周期表中的位置反映了该元素原子结构的特点以及由此决定的元素的性质,所以可以根据元素在周期表的位置,推测它的原子结构和有关性质. |

 阅读快车系列答案
阅读快车系列答案(19分)下表是元素周期表的一部分,回答下列有关问题:(填写元素符号或化学式)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 |
|
|
|
| ① |
| ② |
|
| 3 | ③ | ④ | ⑤ | ⑥ |
| ⑦ | ⑧ |
|
| 4[] | ⑨ |
|
|
|
|
| ⑩ |
|
(1)写出下列元素符号:
① ,⑥ ,⑦ ,⑧ 。
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 。
(3)在这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ,写出实验室制取①的氢化物的化学方程式
(4)含有元素③的物质的焰色呈 ,⑩的单质的保存方法是
(5)在③与④中,化学性质较活泼的是 ,怎样用化学实验证明?(可用化学方程式说明)
在⑧与⑩中,化学性质活泼的是 ,怎样用化学实验证明?(可用化学方程式说明)
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表做的位置可判断①是N、②是F、③是Na、④是Mg、⑤是Al、⑥是Si、⑦是S、⑧是Cl、⑨是K、⑩是Br。同主族元素自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。同周期元素自左向右原子半径逐渐减小,非金属性逐渐增强,金属性逐渐减弱。
(19分)下表是元素周期表的一部分,回答下列有关问题:(填写元素符号或化学式)
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
|
|
4[] |
⑨ |
|
|
|
|
|
⑩ |
|
(1)写出下列元素符号:
① ,⑥ ,⑦ ,⑧ 。
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 。
(3)在这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ,写出实验室制取①的氢化物的化学方程式
(4)含有元素③的物质的焰色呈 ,⑩的单质的保存方法是
(5)在③与④中,化学性质较活泼的是 ,怎样用化学实验证明?(可用化学方程式说明)
在⑧与⑩中,化学性质活泼的是 ,怎样用化学实验证明?(可用化学方程式说明)
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表做的位置可判断①是N、②是F、③是Na、④是Mg、⑤是Al、⑥是Si、⑦是S、⑧是Cl、⑨是K、⑩是Br。同主族元素自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。同周期元素自左向右原子半径逐渐减小,非金属性逐渐增强,金属性逐渐减弱。