题目内容
11.写出下列化学反应的离子方程式.(1)KOH+HCl═KCl+H2OOH-+H+=H2O
(2)2HNO3+CaCO3═Ca(NO3)2+H2O+CO2↑CaCO3+2H+=Ca2++H2O+CO2↑
(3)H2SO4+Ba(OH)2═2H2O+BaSO4↓Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
(4)Fe+CuSO4═FeSO4+CuFe+Cu2+=Fe2++Cu.
分析 (1)该反应的实质为氢离子与氢氧根离子反应生成水;
(2)碳酸钙为难溶物,离子方程式中需要保留化学式;
(3)硫酸钡和水都不能拆开,该反应的离子方程式中将硫酸和氢氧化钡拆开即可;
(4)该反应的实质为铁与铜离子反应生成亚铁离子和铜.
解答 解:(1)氢氧化钾和HCl都是强电解质,离子方程式中二者都需要拆开,反应的离子方程式为:OH-+H+=H2O,
故答案为:OH-+H+=H2O;
(2)硝酸为强酸,需要拆开,碳酸钙为难溶物,需要保留化学式,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:硫酸和氢氧化钡都需要拆开,水和硫酸钡都需要保留化学式,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,
故答案为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(4)反应Fe+CuSO4═FeSO4+Cu的离子方程式为:Fe+Cu2+=Fe2++Cu,
故答案为:Fe+Cu2+=Fe2++Cu.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列有关溶液的说法正确的是( )
| A. | 将质量分数为40%(密度为1.43g•cm-3)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数是20% | |
| B. | 要配制浓度为0.25mol•L-1的NaOH溶液480mL,应称量4.8gNaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 | |
| C. | 配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配浓度偏高 | |
| D. | 配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低 |
19.下列物质属于同系物的是( )
| A. | CH4与CH3CH3 | B. |  与 与 | ||
| C. | CH3COOH与C2H6O | D. | CH3CH2CH2Br与CH3CH2CH3 |
16.下列物质中,属于能导电的电解质是( )
| A. | 蔗糖 | B. | 熔融的氯化钠 | C. | 纯铝导线 | D. | 盐酸 |
3.实验室有两瓶失去标签的溶液,其中一瓶是KHSO4溶液,另一瓶是KOH溶液.鉴别时,下列选用的试纸或试剂不正确的是( )
| A. | pH试纸 | B. | 紫色石蕊试液 | C. | K2CO3固体 | D. | KCl溶液 |
20.下列各组物质中,只用溴水一种试剂不能加以区别的是( )
| A. | 苯己烷甲苯 | B. | 硫化氢二氧化硫二氧化碳 | ||
| C. | 苯苯酚乙醇 | D. | 乙烷乙烯乙炔 |
1.亚碳化合物的特征是在1个碳原子上带有2个未成对电子,亚碳化合物是具有很高反应活性的有机化合物.下列属于亚碳化合物的是( )
| A. | CH3 | B. | H2C5(线状) | C. |  | D. | CH2═CH2 |
 ,B为18电子分子,其结构式为
,B为18电子分子,其结构式为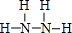 .
.