题目内容
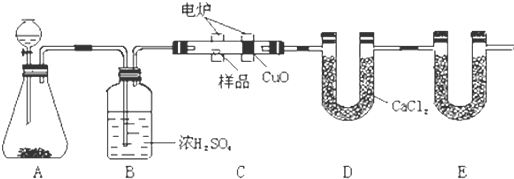
实验室常用二氧化锰和浓盐酸反应制备干燥纯净的氯气,某小组同学进行该实验,所用仪器如图.请回答下列问题:
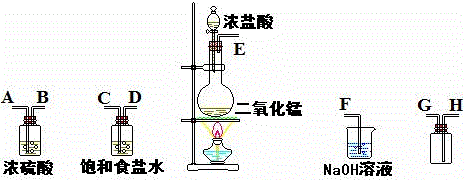
(1)连接上述仪器的正确顺序中(填备接口处的字母):E接 ; 接 ; 接H;G接F.
(2)该装置中,饱和食盐水的 作用是 ;NaOH溶液的作用是 .
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生,该反应的化学方程式为 .
(4)写出气体发生装置中发生反应的离子方程式: .

(1)连接上述仪器的正确顺序中(填备接口处的字母):E接
(2)该装置中,饱和食盐水的 作用是
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生,该反应的化学方程式为
(4)写出气体发生装置中发生反应的离子方程式:
考点:氯气的实验室制法
专题:
分析:(1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(2)根据氯气、氯化氢的溶解性大小分析;氯气有毒,多余的氯气需要用氢氧化钠吸收;
(3)根据氯气的氧化性,碘离子的还原性分析氯气和碘化钾反应生成单质碘和氯化钠;
(4)实验制备氯气气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水.
(2)根据氯气、氯化氢的溶解性大小分析;氯气有毒,多余的氯气需要用氢氧化钠吸收;
(3)根据氯气的氧化性,碘离子的还原性分析氯气和碘化钾反应生成单质碘和氯化钠;
(4)实验制备氯气气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水.
解答:
解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;除杂装置中长导管进气、短导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接盛有饱和食盐水的装置后连接盛浓硫酸的装置;收集装置中,氯气的密度大于空气的,应该采用长进短出的方式,故导管连接顺序为:E-C-D-A-B-H-G-F,
故答案为:C;D;A;B;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;
氯气是有毒的气体,氢氧化钠溶液和氯气反应,所以可用氢氧化钠溶液吸收多余的氯气,防止污染空气,
故答案为:除去挥发出的HCl气体,抑制C12在水中的溶解;吸收多余的Cl2;
(3)实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生.如果有Cl2产生,氯气和碘化钾反应:2KI+Cl2═2KCl+I2,
故答案为:2KI+Cl2═2KCl+I2;
(4)气体发生装置中进行的反应是氯气的实验室制备,反应的离子方程式为:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O,
故答案为:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O.
故答案为:C;D;A;B;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;
氯气是有毒的气体,氢氧化钠溶液和氯气反应,所以可用氢氧化钠溶液吸收多余的氯气,防止污染空气,
故答案为:除去挥发出的HCl气体,抑制C12在水中的溶解;吸收多余的Cl2;
(3)实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生.如果有Cl2产生,氯气和碘化钾反应:2KI+Cl2═2KCl+I2,
故答案为:2KI+Cl2═2KCl+I2;
(4)气体发生装置中进行的反应是氯气的实验室制备,反应的离子方程式为:MnO2+2Cl-+4H+
| ||
故答案为:MnO2+2Cl-+4H+
| ||
点评:本题考查了氯气的实验室制法及其化学性质,题目难度中等,注意明确实验装置仪器的连接顺序为:实验发生装置→除杂装置→收集装置→尾气处理装置;还要掌握实验室制备气体的装置选择、实验除杂的方法选择及试剂作用、化学方程式的书写方法、反应现象判断等知识.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
下列说法正确的是( )
| A、Na2O2、Na2O均能吸收CO2并放出氧气 |
| B、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| C、Na比Cu活泼,将Na投入CuSO4溶液中会有铜析出 |
| D、从lL lmol?L-1的H2SO4溶液中取出10 mL,其中H+浓度为2mol?L-1 |
下列与化学反应能量变化相关的叙述正确的是( )
| A、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
| B、相同条件下2mol氢原子所具有的能量小于1 mol氢分子所具有的能量 |
| C、应用盖斯定律,可以计算某些难以直接测量的反应焓变 |
| D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行:则该反应的△H>0 |
下列化学及实验用语书写正确的是( )
| A、崔化剂 | B、椎形瓶 |
| C、蒸发皿 | D、粹取 |
下列关于电解质溶液的正确判断是( )
| A、由0.1mol/l一元碱HA溶液的pH=3,可推知NaA溶液存在A-+H2O?HA+OH- |
| B、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
| C、由0.1 mol/l一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- |
| D、在pH=12的溶液中,K+、CL-、HCO3-、Na+可以大量共存 |
 有机物A可发生如下转化:
有机物A可发生如下转化: 纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu
纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu