题目内容
某无色溶液,由K+、Mg2+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO32-、SO42-中的若干组成.取该溶液进行下列实验:
①取适量溶液,加入过量盐酸,有无色无味气体生成,并得到溶液.
②向 ①中所得溶液加入过量碳酸氢铵,有气体和白色沉淀析出.
③向②所得溶液加入过量的Ba(OH)2溶液,有气体生成,并且有沉淀生成.
问:(1)溶液中一定不存在的离子是 .
(2)溶液中一定存在的离子是 .
(3)②中沉淀和③中沉淀分别是 、 .怎么判定③中沉淀成分? .
(4)写出②中反应的离子方程式 .
①取适量溶液,加入过量盐酸,有无色无味气体生成,并得到溶液.
②向 ①中所得溶液加入过量碳酸氢铵,有气体和白色沉淀析出.
③向②所得溶液加入过量的Ba(OH)2溶液,有气体生成,并且有沉淀生成.
问:(1)溶液中一定不存在的离子是
(2)溶液中一定存在的离子是
(3)②中沉淀和③中沉淀分别是
(4)写出②中反应的离子方程式
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:溶液无色,一定没有高锰酸根离子,
①能够与盐酸生成无色无味气体的离子为碳酸根离子,能够与碳酸根离子反应的离子不能存在;
②说明发生了双水解,一定存在与碳酸氢根离子发生双水解的离子;
③气体乙为氨气,白色沉淀为碳酸钡或硫酸钡,据此进行推断.
①能够与盐酸生成无色无味气体的离子为碳酸根离子,能够与碳酸根离子反应的离子不能存在;
②说明发生了双水解,一定存在与碳酸氢根离子发生双水解的离子;
③气体乙为氨气,白色沉淀为碳酸钡或硫酸钡,据此进行推断.
解答:
解:某无色溶液,说明溶液中一定不会存在高锰酸根离子,
①加入过量盐酸,有无色无味气体生成,并得到无色溶液,生成的气体甲为二氧化碳,所以溶液中一定存在CO32-,一定不存在SO 32-,因为二氧化硫有刺激性气味,也一定不存在Ag+、Ba2+、Al3+,阳离子只剩下了钾离子,根据溶液一定呈电中性可知溶液中一定存在K+;
②在A所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀,白色沉淀为氢氧化铝,原溶液中一定存在AlO2-,
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,同时析出白色沉淀,白色沉淀一定含有碳酸钡,可能含有硫酸钡,要验证是否有硫酸钡的存在,可以往溶液中滴加盐酸检验,如沉淀部分溶解,则含有碳酸钡和硫酸钡,如沉淀全部溶解,则只含碳酸钡,故答案为:;
(1)由以上分析可知溶液中一定不存在MnO4-、Mg2+、Ba2+、Al3+、SO32-
故答案为:MnO4-、Ag+、Ba2+、Al3+;
(2)由以上分析可知溶液中一定存在:CO32-、K+、AlO2-,故答案为:CO32-、K+、AlO2-;
(3)由以上分析可知,②中的白色沉淀为氢氧化铝,③中的白色沉淀乙一定含有碳酸钡,可能含有硫酸钡,可加入盐酸检验,如沉淀部分溶解,则含有碳酸钡和硫酸钡,如沉淀全部溶解,则只含碳酸钡,
故答案为:Al(OH)3;BaCO3(可能有BaSO4);加入酸看沉淀是否完全溶解,全溶无BaSO4,部分溶有BaSO4;
(4)偏铝酸根与氢离子产生氢氧化铝沉淀,碳酸氢根与氢离子生成二氧化碳,故反应的离子反应方程式为2H++AlO2-+HCO 3-=CO2↑+Al(OH)3↓,故答案为:2H++AlO2-+HCO 3-=CO2↑+Al(OH)3↓.
①加入过量盐酸,有无色无味气体生成,并得到无色溶液,生成的气体甲为二氧化碳,所以溶液中一定存在CO32-,一定不存在SO 32-,因为二氧化硫有刺激性气味,也一定不存在Ag+、Ba2+、Al3+,阳离子只剩下了钾离子,根据溶液一定呈电中性可知溶液中一定存在K+;
②在A所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀,白色沉淀为氢氧化铝,原溶液中一定存在AlO2-,
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,同时析出白色沉淀,白色沉淀一定含有碳酸钡,可能含有硫酸钡,要验证是否有硫酸钡的存在,可以往溶液中滴加盐酸检验,如沉淀部分溶解,则含有碳酸钡和硫酸钡,如沉淀全部溶解,则只含碳酸钡,故答案为:;
(1)由以上分析可知溶液中一定不存在MnO4-、Mg2+、Ba2+、Al3+、SO32-
故答案为:MnO4-、Ag+、Ba2+、Al3+;
(2)由以上分析可知溶液中一定存在:CO32-、K+、AlO2-,故答案为:CO32-、K+、AlO2-;
(3)由以上分析可知,②中的白色沉淀为氢氧化铝,③中的白色沉淀乙一定含有碳酸钡,可能含有硫酸钡,可加入盐酸检验,如沉淀部分溶解,则含有碳酸钡和硫酸钡,如沉淀全部溶解,则只含碳酸钡,
故答案为:Al(OH)3;BaCO3(可能有BaSO4);加入酸看沉淀是否完全溶解,全溶无BaSO4,部分溶有BaSO4;
(4)偏铝酸根与氢离子产生氢氧化铝沉淀,碳酸氢根与氢离子生成二氧化碳,故反应的离子反应方程式为2H++AlO2-+HCO 3-=CO2↑+Al(OH)3↓,故答案为:2H++AlO2-+HCO 3-=CO2↑+Al(OH)3↓.
点评:本题考查了常见离子的检验方法,题目难度不大,注意根据溶液呈电中性判断溶液中存在的离子方法,本题充分考查了学生的分析、理解能力,要求熟练掌握常见离子的检验方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关实验原理、方法和结论都正确的是( )
| A、向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀说明溶液X中一定含有SO42- |
| B、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、粗略配制浓度为2mol?L-1的NaCl溶液,可将58.5g NaCl加入到盛有500mL水的烧杯中,搅拌、溶解 |
| D、对某固体进行焰色反应实验,火焰呈黄色,说明该物质为一定钠盐 |
下列有关实验原理、操作或现象不正确的是( )
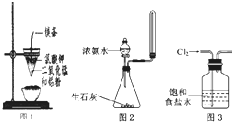

| A、图1装置可制得金属锰,用同样的装置可制得金属铬 |
| B、实验室用图2所示装置制取少量纯净的氨气 |
| C、用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色不能说明该溶液中含有钠元素 |
| D、实验室用图3所示装置除去Cl2中的少量HCl |
检验SO42-的存在,最好选用下列物质中的( )
| A、石蕊溶液 | B、碳酸钠溶液 |
| C、硝酸溶液 | D、氯化钡溶液 |
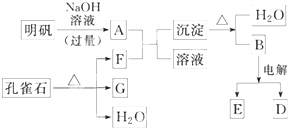 在一定条件下可实现如图所示物质之间的变化:
在一定条件下可实现如图所示物质之间的变化: 新型绿色硝化剂N205较传统硝化剂具有反应热效应小、温度容易控制、产物分离简单等优点,因而得到广泛的应用.
新型绿色硝化剂N205较传统硝化剂具有反应热效应小、温度容易控制、产物分离简单等优点,因而得到广泛的应用.