题目内容
8.配制0.2mol/L下列物质的溶液各50mL,需下列各物质的用量分别为:①NaOH0.4g;②H2SO40.98g;③CuSO4•5H2O2.5g;④HCl(标准状况)224mL.
分析 根据容量瓶的常用的规格为50mL、100mL、250mL、500mL、1000mL可知,配制配制0.2mol/L下列物质的溶液各50mL需选用50mL容量瓶.
①求出所需的NaOH的物质的量,根据m=nM求出质量;
②求出所需的H2SO4的物质的量,根据m=nM求出质量;
③求出所需的CuSO4•5H2O的物质的量,根据m=nM求出质量;
④求出所需的HCl的物质的量,根据V=nVm求出体积.
解答 解:根据容量瓶的常用的规格为50mL、100mL、250mL、500mL、1000mL可知,配制配制0.2mol/L下列物质的溶液各50mL需选用50mL容量瓶,配制出0.2mol/L 50mL溶液.
①所需的NaOH的物质的量n=CV=0.2mol/L×0.05L=0.01mol,质量m=nM=0.01mol×40g/mol=0.4g,故答案为:0.4;
②所需的H2SO4的物质的量n=CV=0.2mol/L×0.05L=0.01mol,质量m=nM=0.01mol×98g/mol=0.98g,故答案为:0.98;
③配制0.2mol/L 50mLCuSO4溶液,所需CuSO4的物质的量n=CV=0.2mol/L×0.05L=0.01mol,而1molCuSO4•5H2O中含1molCuSO4,故需要的0.01molCuSO4需要0.01molCuSO4•5H2O来提供,即所需的CuSO4•5H2O的物质的量为0.01mol,质量m=nM=0.01mol×250g/mol=2.5g,故答案为:2.5;
④所需的HCl的物质的量n=CV=0.2mol/L×0.05L=0.01mol,在标况下的体积V=nVm=0.01mol×22.4L/mol=0.224L=224mL,故答案为:224.
点评 本题考查了在配制一定物质的量浓度的溶液的时候所需溶质的计算,熟练掌握公式是解题关键,难度不大.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 白、红、白 | B. | 红、黑、红 | C. | 红、红、红 | D. | 白、黑、白 |
| A. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
| A. | AgNO3溶液 | B. | 稀硫酸 | C. | 稀盐酸 | D. | 稀硝酸 |
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1 mol•L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | 升高温度,HCN溶液中H+浓度增大,平衡正向移动,电离平衡常数增大 | |
| C. | 向稀醋酸中逐滴加水,或加入少量冰醋酸,CH3COOH的电离平衡都正向移动 | |
| D. | 向CH3COOH溶液中加入少量氢氧化钠固体,平衡正向移动 |
| A. | 实验室制NH3:NH4++OH-$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| B. | NaOH与NH4Cl溶液混合加热:NH4++OH-$\frac{\underline{\;△\;}}{\;}$NH3•H2O | |
| C. | 氨水中加盐酸:NH3•H2O+H+═NH4++H2O | |
| D. | 氨气通入稀H2SO4中:NH3+H+═NH4+ |

 .
. .
.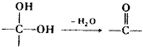 ②
② 中氯原子较难水解物质A(
中氯原子较难水解物质A( )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 +2Cl2
+2Cl2
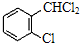 +2HCl、
+2HCl、 +2NaOH
+2NaOH
 +2NaCl+2H2O.
+2NaCl+2H2O. 和
和 .
. ,两个取代基分别在间位和对位,共3种
,两个取代基分别在间位和对位,共3种
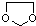 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$