题目内容
18.某类化学反应可用如下通式表示:A+B→C+D+H2O 请按要求回答问题:(1)若A、C、D中均含有氯元素,且A中的Cl的化合价介于C和D之间,写出该反应的离子方程式:Cl2+2OH-═Cl-+ClO-+H2O;
(2)若A是紫红色金属,D为红棕色气体,写出该反应的离子方程式:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(3)若C和D均为气体且都能使澄清的石灰水变浑浊,A呈固态,则反应的化学方程式为C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)若C是一种碱性气体,能使湿润的红色石蕊试纸变蓝,D是一种固体可作干燥剂(中性),反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;干燥C气体所用的干燥剂的名称为碱石灰.
分析 (1)若A、C、D中均含有氯元素,且A中的Cl的化合价介于C和D之间,则A为氯气、B为氢氧化钠;
(2)若A是紫红色金属,D为红棕色气体,为铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
(3)若C和D均为气体且都能使澄清的石灰水变浑浊,A呈固态,B为液态,为碳与浓硫酸反应生成二氧化碳、二氧化硫与水;
(4)若C是一种碱性气体,能使湿润的红色石蕊试纸变蓝,则C为氨气,D是一种固体可作干燥剂(中性),为氯化铵与氢氧化钙反应生成氨气、氯化钙与水;
解答 解:(1)若A、C、D中均含有氯元素,且A中的Cl的化合价介于C和D之间,氯气与氢氧化钠反应符合转化关系,则A为Cl2、B为氢氧化钠,该反应为氯气在碱性条件下的歧化反应,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)若A是紫红色金属,D为红棕色气体,为铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应的化学方程式为Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(3)若C和D均为气体且都能使澄清的石灰水变浑浊,A呈固态,B为液态,为碳与浓硫酸反应生成二氧化碳、二氧化硫与水,反应的方程式为C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)若C是一种碱性气体,能使湿润的红色石蕊试纸变蓝,则C为氨气,D是一种固体可作干燥剂(中性),为氯化铵与氢氧化钙反应生成氨气、氯化钙与水,则反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,干燥氨气所用的干燥剂的名称为碱石灰,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;碱石灰.
点评 本题考查无机物推断,基本属于开放性题目,物质的颜色、性质等是推断突破口,需要学生熟练掌握元素化合物性质及常见的特殊反应.

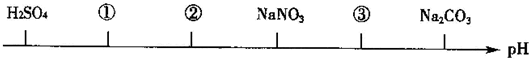
| A. | CuCl2 CH3COOH NaOH | B. | HCl H2SO3 NaHCO3 | ||
| C. | HF HCl CH3COONa | D. | NH4Cl HCl CH3COONa |
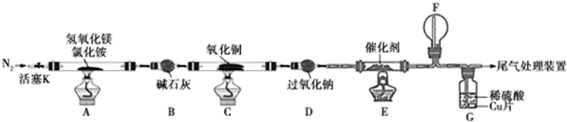
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
| A. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)═2CO(g) 的△H=+172.5kJ•mol-1 |
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y2?XY2 | D. | 2X2+Y2?2X2Y |
 病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
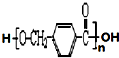
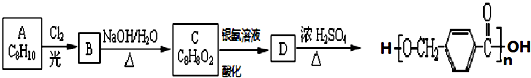
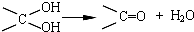
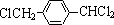 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.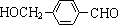 +2Ag(NH3)2OH $\stackrel{△}{→}$
+2Ag(NH3)2OH $\stackrel{△}{→}$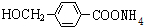 +2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n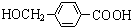 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$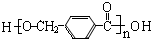 +(n-1)H2O
+(n-1)H2O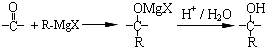
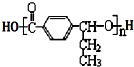 在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)