题目内容
【题目】广东河源市东源县某村土壤的主要成份是Al2O3、Fe3O4及SiO2,广州大学附属东江中学“探险号”化学兴趣小组设计以下流程提取金属铝:
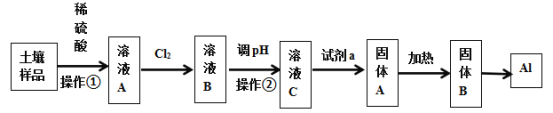
信息提示:氧化铝在电解条件下可得金属铝;Fe(OH)3、Al(OH)3、Fe(OH)2开始沉淀与完全沉淀的pH数据表:
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | |
开始沉淀的pH | 2.7 | 3.3 | 5.9 |
完全沉淀的pH | 3.2 | 5.2 | 8.4 |
(1)溶液A含有的金属阳离子为_________________固体B的化学式为_______________________
(2)步骤中通入氯气时的离子方程式为___________________________________________________
(3)溶液C的pH范围是_____________________,操作②的名称是_________________________
(4)通入试剂a的离子方程式为_________________________________________________________
【答案】Al3+、Fe2+、Fe3+ Al2O3 Cl2 + 2Fe2+ == 2Cl- + 2Fe3+ 3.2≤pH<3.3 过滤 Al3+ + 3NH3·H2O == Al(OH)3↓ + 3NH4+
【解析】
Al2O3与稀硫酸反应生成硫酸铝和水,Fe3O4与稀硫酸反应生成硫酸铁、硫酸亚铁和水,SiO2和稀硫酸不反应,所以溶液A中含有硫酸铝、硫酸铁、硫酸亚铁;溶液A通入氯气,氯气把Fe2+氧化为Fe3+;调节pH除去Fe3+,过滤后,向溶液C中通入氨水,生成氢氧化铝沉淀,过滤,加热氢氧化铝,分解为氧化铝,电解熔融氧化铝生成单质铝。
(1) Al2O3与稀硫酸反应生成硫酸铝和水,Fe3O4与稀硫酸反应生成硫酸铁、硫酸亚铁和水,SiO2和稀硫酸不反应,溶液A中含有硫酸铝、硫酸铁、硫酸亚铁,溶液A含有的金属阳离子为Al3+、Fe2+、Fe3+;固体A是氢氧化铝,加热氢氧化铝,分解为氧化铝,所以固体B是氧化铝,化学式为Al2O3;
(2)通入氯气时,氯气把Fe2+氧化为Fe3+,反应的离子方程式为Cl2 + 2Fe2+ = 2Cl- + 2Fe3+;
(3) 调节pH的目的是除去Fe3+,所以溶液C的pH范围是3.2≤pH<3.3,操作②是分离出氢氧化铁沉淀,操作②的名称是过滤;
(4)通入试剂a的目的是生成氢氧化铝沉淀,试剂a是氨水,反应的离子方程式为Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+。