题目内容
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
①31g白磷含有的P-P键数为NA
②1mol(碳正离子)中含有电子数为10NA
③1mol铜与足量硫蒸气反应,转移电子数为2NA
④用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA
⑤0.84g NaHCO3晶体中阳离子和阴离子总数为0.03NA
⑥3.9g Na2O2吸收足量的CO2时转移的电子数是0.05NA
⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA.
①31g白磷含有的P-P键数为NA
②1mol(碳正离子)中含有电子数为10NA
③1mol铜与足量硫蒸气反应,转移电子数为2NA
④用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA
⑤0.84g NaHCO3晶体中阳离子和阴离子总数为0.03NA
⑥3.9g Na2O2吸收足量的CO2时转移的电子数是0.05NA
⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA.
| A、①②④ | B、④⑥ |
| C、③④⑤ | D、④⑥⑦ |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:①依据n=
计算物质的量,结合白磷分子结构计算分析;
②碳正离子含有一个只带6个电子的带正电荷的碳氢基团;
③硫和铜反应生成是硫化亚铜;
④依据电解反应和电子守恒计算分析;
⑤依据n=
计算物质的量,结合碳酸氢钠由钠离子和碳酸氢根离子构成分析;
⑥依据n=
计算物质的量,过氧化钠中氧元素化合价-1价变化为-2价和0价,1mol过氧化钠反应电子转移1mol;
⑦二氧化氮聚合生成四氧化二氮;
| m |
| M |
②碳正离子含有一个只带6个电子的带正电荷的碳氢基团;
③硫和铜反应生成是硫化亚铜;
④依据电解反应和电子守恒计算分析;
⑤依据n=
| m |
| M |
⑥依据n=
| m |
| M |
⑦二氧化氮聚合生成四氧化二氮;
解答:
解:①依据n=
计算物质的量=
=0.25mol,结合白磷分子结构分析,1mol白磷含有6molP-P键,0.25mol白磷含有的P-P键数=0.25mol×6×NA=1.5NA,故①错误;
②碳正离子含有一个只带6个电子的带正电荷的碳氢基团,1mol(碳正离子)中含有电子数为6NA,故②错误;
③硫和铜反应生成是硫化亚铜,1mol铜与足量硫蒸气反应,转移电子数为NA,故③错误;
④依据电极反应和电子守恒计算分析,用惰性电极电解CuCl2溶液,阴极析出32g铜时物质的量为0.5mol,Cu2++2e-=Cu,线路中通过的电子数为NA,故④正确;
⑤依据n=
计算物质的量=
=0.01mol,结合碳酸氢钠由钠离子和碳酸氢根离子构成分析,晶体中阳离子和阴离子总数为0.02NA,故⑤错误;
⑥依据n=
计算物质的量=
=0.05mol,过氧化钠中氧元素化合价-1价变化为-2价和0价,1mol过氧化钠反应电子转移1mol,3.9g Na2O2吸收足量的CO2时转移的电子数是0.05NA,故⑥正确;
⑦二氧化氮聚合生成四氧化二氮,标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数小于0.1NA,故⑦错误;
故选B.
| m |
| M |
| 31g |
| 124g/mol |
②碳正离子含有一个只带6个电子的带正电荷的碳氢基团,1mol(碳正离子)中含有电子数为6NA,故②错误;
③硫和铜反应生成是硫化亚铜,1mol铜与足量硫蒸气反应,转移电子数为NA,故③错误;
④依据电极反应和电子守恒计算分析,用惰性电极电解CuCl2溶液,阴极析出32g铜时物质的量为0.5mol,Cu2++2e-=Cu,线路中通过的电子数为NA,故④正确;
⑤依据n=
| m |
| M |
| 0.84g |
| 84g/mol |
⑥依据n=
| m |
| M |
| 3.9g |
| 78g/mol |
⑦二氧化氮聚合生成四氧化二氮,标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数小于0.1NA,故⑦错误;
故选B.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积,物质的量计算,氧化还原反应电子转移计算应用,物质结构理解是关键,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、同一主族的元素,原子半径越大,其单质的熔点越高 |
| B、晶体熔化时,化学键不一定发生断裂 |
| C、位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高化合价一定是X<Y |
| D、将pH=2,体积相同的盐酸和醋酸溶液均稀释100倍后,分别加入足量的相同颗粒大小的锌,产生H2的起始速率相同,醋酸放出的氢气多 |
下列关于有机化合物的说法正确的是( )
A、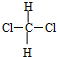 和 和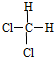 是两种不同的物质 是两种不同的物质 |
| B、淀粉和纤维素水解最终产物都是葡萄糖 |
| C、丁烷有2种同分异构体 |
| D、淀粉、纤维素、蛋白质、油脂都属于天然高分子化合物 |
下列叙述错误的是( )
| A、1mol任何粒子都含有约6.02×1023个原子 |
| B、阿佛加德罗常数的数值约为6.02×1023 |
| C、1mol H+中含有约6.02×1023个质子 |
| D、物质的量是国际单位制中七个基本物理量之一 |
工业上冶炼金属钼的化学原理为:则下列说法正确的是( )
①2MoS2+7O2
2MoO3+4SO2;
②MoO3+2NH3?H2O═(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl═H2MoO4↓+2NH4Cl;
④H2MoO4
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼.
①2MoS2+7O2
| ||
②MoO3+2NH3?H2O═(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl═H2MoO4↓+2NH4Cl;
④H2MoO4
| ||
⑤用还原剂将MoO3还原成金属钼.
| A、上述①、③、⑤属于氧化还原反应,②、④属于非氧化还原反应 |
| B、MoO3是金属氧化物,也是碱性氧化物 |
| C、H2MoO4是一种强酸 |
| D、利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2 |
下列说法正确的是( )
| A、等质量的乙烯和丙烯中含有的共用电子对数目相等 |
| B、等质量的 14NO和 13CO气体中含有的中子数相等 |
| C、向溴苯中滴入AgNO3溶液检验其中的溴元素 |
| D、溴苯可用溴的CCl4溶液和苯在FeCl3条件下制得 |
同温同压下两个容积相等的贮气瓶,一个装有H2气体,另一个装有O2和N2的混合气体,则两瓶内的气体一定不相同的是( )
| A、气体质量 | B、气体的物质的量 |
| C、分子总数 | D、原子数 |