题目内容
向含有K+、Mg2+、Fe2+和Al3+的溶液中加入足量Na2O2微热并搅拌后,再加入过量稀盐酸,溶液中大量减少的离子是
- A.Mg2+
- B.Fe2+
- C.Al3+、Mg2+
- D.Al3+
B
试题分析:向溶液中加入过氧化钠,过氧化钠与水生成氢氧化钠和氧气,镁离子、亚铁离子、铁离子分别形成Mg(OH)2沉淀、Fe(OH)2沉淀、AlO2-,微热并搅拌,4Fe(OH)2+O2+2H2O=4Fe(OH)3,再加过量盐酸发生反应:Mg(OH)2+2H+=Mg2++2H2O、Fe(OH)3+3H+=Fe3++3H2O、AlO2-+4H+=Al3++2H2O。所以大量减少的离子是Fe2+。
考点:无机化学反应
点评:氢氧化亚铁不稳定,在空气中很容易被氧化成氢氧化铁。
试题分析:向溶液中加入过氧化钠,过氧化钠与水生成氢氧化钠和氧气,镁离子、亚铁离子、铁离子分别形成Mg(OH)2沉淀、Fe(OH)2沉淀、AlO2-,微热并搅拌,4Fe(OH)2+O2+2H2O=4Fe(OH)3,再加过量盐酸发生反应:Mg(OH)2+2H+=Mg2++2H2O、Fe(OH)3+3H+=Fe3++3H2O、AlO2-+4H+=Al3++2H2O。所以大量减少的离子是Fe2+。
考点:无机化学反应
点评:氢氧化亚铁不稳定,在空气中很容易被氧化成氢氧化铁。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向含有K+、Mg2+、Fe2+和Al3+的溶液中加入足量Na2O2微热并搅拌后,再加入过量稀盐酸,溶液中大量减少的离子是
| A.Mg2+ | B.Fe2+ | C.Al3+、Mg2+ | D.Al3+ |
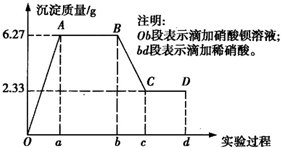 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
 、SO
、SO 、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如右图所示:
、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如右图所示: