题目内容
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水淡化的方法有蒸馏法、________________________(填1种方法)。
(2)海水中制得的饱和氯化钠溶液可以利用电解法直接制取次氯酸钠,制取的离子方程式为____。
(3)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

将Br2与Na2CO3反应的化学方程式补充完整:
___Br2+___Na2CO3===___NaBrO3+___ ________+___ ________
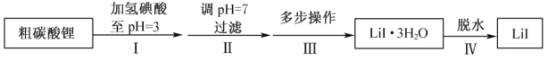
(4)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

已知:常温下0.010 mol·L-1金属离子在不同pH下的沉淀情况如下:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是_____________。
②NaClO还能除去盐卤中的CO(NH2)2,生成盐和一种能参与大气循环的物质。除去0.2 mol CO(NH2)2时消耗NaClO ________g。
【答案】电渗析法(或离子交换法) Cl-+H2O![]() ClO-+H2↑ 3 3 1 5 NaBr 3 CO2↑ 除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去 44.7
ClO-+H2↑ 3 3 1 5 NaBr 3 CO2↑ 除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去 44.7
【解析】
(1)海水淡化的方法主要有蒸馏法、电渗析发和离子交换法;
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(3)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,根据化合价升降守恒配平方程式;
(4)盐卤加水溶解,加NaClO将Fe2+氧化为Fe3+,然后加入NaOH调节溶液的pH为9.8,使Fe2+、Fe3+、Mn2+转化为沉淀,过滤后,滤液经过蒸发浓缩,冷却结晶,过滤可得到氯化镁的晶体,在HCl氛围中加热可得到无水氯化镁,电解熔融的氯化镁的可制取单质镁,以此解答。
(1)海水淡化的方法主要有蒸馏法、电渗析发和离子交换法;
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl-+H2O![]() ClO-+H2↑;
ClO-+H2↑;
(3)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,根据化合价升降守恒配平后反应的方程式为:3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;
(4)①步骤②中加入NaOH调节溶液的pH为9.8,可使除Mg2+以外的所有金属离子均成为沉淀,以便过滤除去;
②NaClO还能除去盐卤中的CO(NH2)2,生成盐和一种能参与大气循环的物质,反应的方程式为:3NaClO+ CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O,因此除去0.2 mol CO(NH2)2时消耗NaClO的物质的量为0.6mol,其质量为0.6mol×74.5g/mol=44.7g。

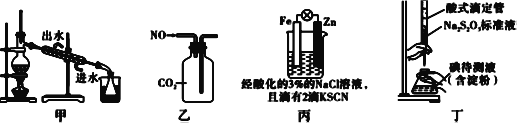
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D